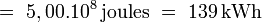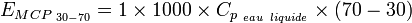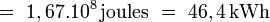- Materiau a changement de phase
-
Matériau à changement de phase
- On appelle Matériau à Changement de Phase - ou MCP - tout matériau capable de changer d'état physique dans une plage de température restreinte. Cette plage est grossièrement située entre 10 et 80 degrés. Dans cet intervalle de température, le changement de phase prépondérant reste la fusion/solidification. Ces températures sont accessibles naturellement et sont omniprésentes dans notre vie quotidienne (température d'ambiance d'une maison, température d'un corps humain, de l'eau chaude sanitaire...)
- Dans la suite de l'article, nous n'aborderons que les MCP dont le changement d'état se situe entre les phases liquides et solides.
Sommaire
Principe du changement de phase : Chaleur Sensible et Chaleur Latente
- Tout matériau, solide ou liquide (ou gazeux) possède une capacité à stocker ou céder de l'énergie sous forme de chaleur. On distingue 2 types de transfert de chaleur (ou transfert thermique):
-
-
-
- Le transfert thermique par Chaleur Sensible (CS) : dans ce cas, le matériau en question peut céder ou stoker de l'énergie en voyant varier sa propre température, sans pour autant changer d'état. La grandeur utilisée pour quantifier la CS échangée par un matériau est la Chaleur Massique, notée Cp et exprimée en J/(kg.K).
-
-
Exemple :
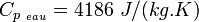 signifie qu'il faut 4186 joules pour élever 1 kg d'eau de 1 °C (valable aux températures proches de 20 °C)
signifie qu'il faut 4186 joules pour élever 1 kg d'eau de 1 °C (valable aux températures proches de 20 °C)
-
-
-
- Le transfert thermique par Chaleur Latente (CL) : dans ce cas, le matériau peut stocker ou céder de l'énergie par simple changement d'état, tout en conservant une température constante, celle du changement d'état. La grandeur utilisée pour quantifier la CL échangée par un matériau est la Chaleur Latente de Changement de Phase notée Lf (f pour fusion) pour un changement de phase Liquide/Solide, et Lv (v pour vaporisation) pour un changement de phase Liquide/Vapeur. Celle-ci est exprimée en J/kg.
-
-
Exemple :
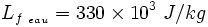 signifie que la fusion, c'est-à-dire la fonte, de 1 kg de glace
à la température (constante) de 0 °C nécessitera une énergie de 330000 joules soit 330 kJ.
signifie que la fusion, c'est-à-dire la fonte, de 1 kg de glace
à la température (constante) de 0 °C nécessitera une énergie de 330000 joules soit 330 kJ.
Interêts des Matériaux à Changement de Phase
Compacité ou Densité Énergétique
Il est important de noter que les quantités d'énergie mises en jeu dans le processus de Changement de Phase sont bien plus importantes que celles qui interviennent lors de transferts sensibles (dans la mesure où l'on travaille sur des intervalles restreints de températures). C'est grâce à ces transferts latents qu'il est aujourd'hui possible de réduire considérablement le volume d'un élément de stockage d'énergie (Compacité), ou encore d'augmenter très fortement la quantité d'énergie contenue dans un même volume de stockage (Densité Énergétique).
- On notera, d'autre part, qu'un MCP peut cumuler les 2 types de transferts thermiques décrits précédemment.
Exemple :
Nom Acétate trihydrate de sodium Tfusion 55-58 °C Lf 242,85.10³ J/kg Cpsolide 3,31.10³ J/(kg.K) à 30 °C Cpliquide 3,06.10³ J/(kg.K) à 70 °C ρ liquide 1279 kg/m³ à 30 °C ρ solide 1392 kg/m³ à 70 °C -
- Densité Énergétique
- L'énergie E30-70 accumulée par 1 m³ de ce MCP entre 30 °C et 70 °C vaut :
-
- Sur le même intervalle de température, le même volume d'eau (1 m³) accumulerait une quantité Eeau30-70 :
-
- Le MCP considéré a donc permis de stocker plus de 3 fois plus d'énergie pour un même volume. Il possède donc une plus grande Densité Énergétique.
-
- Compacité
- De la même manière, pour stocker 100 kWh de 55 °C à 58 °C, nous avons besoin des volumes V eau et V MCP suivants :
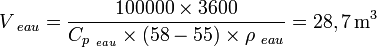
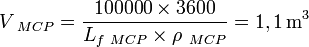
- Le volume du MCP utilisé pour stocker 100 kWh entre 55 °C et 58 °C est donc plus de 26 fois plus petit que celui de l'eau. Il possède donc une plus grande Compacité.
Régulation Thermique Passive ou Rôle Tampon
- Le caractère isotherme ou quasi isotherme de la charge et de la décharge énergétique d'un MCP permet son utilisation en temps que régulateur de température : en effet, si l'on intègre ce dernier à l'enveloppe (murs extérieurs, plancher, plafond, ...) d'un bâtiment, il devient alors possible de stocker de la chaleur lorsque celle-ci est surabondante (été) ou présente au mauvais moment (dans la journée l'hiver).
- En été, l'énergie solaire apportée au cours de la journée est stockée au fur et à mesure par les parois et ce, sans fluctuation excessive de la température à l'intérieur du bâtiment. Selon le CSTB[1], il est alors possible d'écrêter de 3 °C à 5 °C les pics de température d'une pièce.
- En hiver, on peut de la même manière stocker la chaleur apportée par le soleil dans les MCP incorporés aux parois ; ceux-ci restitueront la chaleur accumulée dans la journée à la fin de la journée et pendant la nuit.
Par ailleurs, tout MCP peut servir de déphaseur thermique : tout apport ou perte énergétique (variation de température, rayonnement solaire,...) en provenance du milieu ambiant peut provoquer la fusion ou la cristallisation du matériau à température quasi constante. Dès lors, le milieu situé de l'autre côté du MCP ne ressent pas aussitôt l'effet de cet apport ou de cet perte, mais ne commencera à le ressentir qu'après la fusion ou la cristallisation totale du matériau.
Éventail de températures
- Les MCP, grâce à leur grande variété possèdent des températures de fusion différentes. Ces dernières balayent la totalité de la zone de température restrictive dans laquelle nous nous sommes placés initialement. Cela permet, par exemple, de choisir des températures de fusion proches de 19°C et 27°C, respectivement températures limites de confort hivernal et estival. Le paragraphe suivant présente un tableau non exhaustif de différents matériaux à changement de phase, accompagnés de leur température de fusion et autres données techniques.
Exemples et Types de Matériaux à Changement de Phase
- Il existe de nombreux types de matériaux à changement de phase, de nature physico-chimique très différentes les unes des autres.
Ce sont leurs caractéristiques de fusion-cristallisation qui les rendent intéressants pour le stockage de chaleur latente. Parmi ces matériaux, on distingue les 3 grandes familles suivantes:
-
- Les composés minéraux (ou inorganiques)
Parmi ces composés, seuls les sels hydratés présentent un intérêt pour leur utilisation en tant que MCP. Ils sont issus d'un alliage de sels organiques et d'eau.
Ils ont l'avantage de posséder des grandes chaleurs latentes et des prix bas.
En revanche, leur principal défaut concerne leur tendance à la surfusion.-
- Les composés organiques
De propriétés thermiques (chaleur latente et conductivité thermique en particulier) moindre que les sels hydratés, ceux-ci présentent l'avantage de n'être pas ou très peu concernés par la surfusion. On utilise en particulier, pour le stockage de chaleur latente, les paraffines et les acides gras qui appartiennent à cette famille.
-
- Les composés eutectiques
Les Eutectiques sont un mélange de sels possédant une température de fusion constante pour une valeur particulière de concentration.
Ils peuvent être inorganiques et/ou organiques.Nom Tfusion (°C) Lf (kJ/kg) Cpsolide (kJ/(kg.K)) Cpliquide (kJ/(kg.K) ρ solide (kg/m³) ρ liquide (kg/m³) Composés Organiques Acide formique 8,3 247 ? 0,099 ? 1220 Acide acétique 16,7 194 ? ? 1266 1049 Phénol 40,8 120 ? ? 1070 ? Acide dodécanoïque 41-43 211,6 1,76 2,27 1007 862 Acétate trihydrate de sodium 55-58 242,85 3,31 à 30°C 3,06 à 70°C 1392 à 30°C 1279 à 70°C Hydroxyde de Sodium 64,3 272,15 1,88 à 30°C 2,18 à 70°C 1720 à 30°C 1670 à 70°C Composés Inorganiques H2O (Eau) 0 330 2,06 à 0°C 4,186 à 20°C 998 à 20°C 917 à 0°C H2SO4 (Acide Sulfurique) 10,4 100 ? ? ? 1838 SO3 (Trioxyde de soufre) 16,9 108 ? 0,024 ? 1920 H3PO4 (Acide Phosphorique) 26,0 147 ? ? 1834 1685 Ga (Gallium) 29,8 80 0,370 ? 5904 ? Applications
Stockage solaire thermique
 Schéma de principe d'un Chauffe-eau solaire muni d'un échangeur de chaleur tubulaire côté ECS
Schéma de principe d'un Chauffe-eau solaire muni d'un échangeur de chaleur tubulaire côté ECS
- Le principal problème lié à l'utilisation de l'énergie solaire thermique concerne son stockage : la production d'Eau Chaude Sanitaire (ECS) via la circulation d'eau au-travers de panneaux solaires est directement dépendante de l'ensoleillement. Cet apport énergétique a lieu que l'on en aie besoin (bénéfique) ou non (perte énergétique par surabondance). L'utilisation de MCP pour le stockage de cette énergie par chaleur latente permettrait de résoudre en partie ce problème :
-
- d'une part, la quantité d'énergie stockée dans un ballon de même volume sera plus grande avec un MCP qu'avec de l'eau seule (cf. paragraphe Compacité ou Densité Énergétique) : il sera donc possible d'accumuler une plus grande quantité de chaleur que celle nécessaire à une seule journée d'occupation.
- par ailleurs, ne pouvant élever indéfiniment la température du volume de stockage (risque de vaporisation du fluide néfaste aux pompes de circulation), il est en revanche possible de stocker cette chaleur sous forme latente sans pour autant élever la température du matériau (en utilisant par exemple un MCP dont la température de fusion se situe aux environs de 60°C ou 70°C). Cette chaleur supplémentaire accumulée sera cédée par la suite au réseau d'Eau Chaude Sanitaire.
-
La société Kaplan Energy est le premier fabricant a équiper ses CESI et SSC avec des batteries solaires thermiques constituées de MCP. Ces batteries thermiques permettent ainsi aux chauffe-eau solaires de stocker en continu la surproduction solaire de certains jours pour la restituer les jours sans soleil.
Amélioration de la stratification d'un ballon d'Eau Chaude Sanitaire (ECS) solaire
 Schéma de principe d'un Chauffe-eau solaire à stratification
Schéma de principe d'un Chauffe-eau solaire à stratification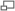
- Le principal problème de stockage de l'énergie au sein d'un ballon d'ECS solaire est l'absence de stratification (l'intégralité du volume d'eau chaude contenue dans le ballon n'est que rarement prélevée en une seule fois) : le volume d'eau à l'intérieur du ballon a tendance à homogénéiser sa température lors de son retour et de son départ vers les panneaux. Une fois une température trop basse atteinte (par exemple 40°C), il n'est plus possible d'utiliser cette eau pour le circuit d'ECS. Pourtant, il suffit que cette chaleur soit "mieux répartie" pour que l'on puisse encore puiser de l'eau à une température convenable (un ballon de 100L à 40°C contient la même quantité d'énergie que 2 ballons de 50L aux températures respectives de 30 et 50°C).
- L'utilisation de MCP permet alors la création de "couches stratifiées" dont les températures se situeront aux environs des températures de fusion des différents matériaux utilisés. Ainsi, un puisage intermittent ou ponctuel d'ECS entraîne la baisse de température de la partie haute du ballon (cf. schéma) dépourvue de nodules (=capsules) de MCP. En revanche, un puisage plus long entraîne l'utilisation de l'énergie contenue dans les couches inférieures du ballon, c'est-à-dire de la chaleur latente contenue dans les nodules. Ceux-ci fondent si nécessaire et cèdent ainsi leur énergie à l'eau de ville en la réchauffant.
Climatisation Passive
- Certaines entreprises comme EVIEE proposent d'ores et déjà des systèmes d'isolation utilisant des MCP. Ceux-ci se présentent sous forme de panneaux rigides contenant un isolant mélangé à un matériau confiné sous forme de micro-capsules. Ces panneaux sont généralement recouvert d'une feuille d'aluminium afin de réduire l'impact du rayonnement sur le bâtiment isolé.
L'utilisation de tels matériaux présente un double intérêt :
-
- Du fait de leur grande compacité, les MCP permettent au bâtiment d'acquérir une grande inertie thermique et donc d'être moins sensible aux variations quotidiennes de température. Selon les études[2][3], il serait possible de réduire de 7 à 8°C maximum les pics de température dans un bâtiment en utilisant de tels isolants.
- Le phénomène de changement de phase permet, quant à lui, d'absorber une partie de la chaleur de la pièce dès que la température ambiante dépasse la température de fusion du matériau. Cet écart de température entre le matériau et la pièce (=réserve énergétique) va être réduit et la température de la pièce va tendre vers celle du matériau: dans la mesure où l'échange énergétique qui a lieu entre les 2 systèmes se fait de manière quasi isotherme pour le MCP, c'est l'environnement qui va voir baisser sa température afin de permettre la fusion des micro-billes d'isolant.
Intégration aux textiles : Régulation thermique corporelle
- Développés depuis maintenant plusieurs années par la recherche spaciale aux États-Unis, les MCP font depuis peu leur apparition dans l'industrie textile. Le but recherché est de réguler de manière passive la température corporelle en fonction de la température du milieu ambiant. Il devient alors particulièrement important de trouver des matériaux dont les températures de fusion et de cristallisation sont très proches de la température superficielle du corps humain.
Les matériaux utilisés pour ce genre d'applications sont généralement des paraffines, un matériau organique à chaîne carbonnée linéaire, contenant une combinaison d'eicosane, d'octadécane, de nonadécane, d'heptadécane et d'hexadécane. Ces différents composés possèdent tous des températures de changement de phase différentes mais, une fois mélangés et encapsulés, ils se maintiennent à une température moyenne de 30-34°C, ce qui devient très confortable pour le corps humain.
- L'utilisation de ces textiles peut se faire dans des domaines tels que :
-
- L'industrie automobile, dans laquelle le problème de la climatisation reste majeur : une intégration correcte de MCP à l'intérieur de l'habitacle permettrait une meilleure régulation des pics de chaleur, et donc une diminution de l'utilisation d'une climatisation nuisible à l'environnement.
- Les vêtements techniques : ceux-ci ne permettent généralement pas d'atteindre un équilibre entre la chaleur produite par le corps et celle transmise à l'environnement lors de la pratique d'un sport. Cet excès de chaleur non évacuée provoque généralement des situations de stress thermique néfastes à l'activité pratiquée.
L'utilisation de vêtements régulateurs de chaleur pourrait alors permettre de diminuer cet inconfort et d'augmenter ainsi les capacités et l'efficacité des personnes lors d'activités physiques ou lors de situations de stress. - L'aérospaciale : certains produits aujourd'hui dans le commerce ont été à l'origine développés pour la création de combinaisons d'astronautes. Ils avaient pour but de les protéger des variations extrèmes de température présentes à l'extérieur des navettes lors des sorties.
-
Prix
Certaines technologies présentées dans les paragraphes précédents sont maintenant mûres de nos jours. La société Kaplan Energy commercialise déjà dans ses CESI et SSC des batteries solaires thermiques "E-Stocker" constituées de MCP. Elles offrent des alternatives énergétiques intéressantes, et permettent, entre autres, de réduire de manière significative les coûts liés à l'utilisation d'un chauffe-eau solaire ou d'une climatisation.
Surfusion
- La surfusion correspond à l'état liquide d'un corps alors que sa température est inférieure à la température de cristallisation.
Elle n'apparaît que pour certains types de MCP comme les matériaux inorganiques. Les solutions pour remédier à ce problème sont multiples :
-
- incorporation d'additifs tensio-actifs
- faciliter la nucléation au moyen de cristaux solides stables autour de la température de cristallisation : ceux-ci servent de points d'accroche pour la cristallisation du matériau
- garder une zone froide à l'intérieur du matériau
La surfusion empèche l'utilisation de la chaleur latente de changement de phase à la température voulue.
Cinétique de cristallisation
- Les vitesses de cristallisation des MCP sont relativement faibles. S'il faut trop de temps au matériau pour accumuler ou libérer de l'énergie, celui-ci perd alors en efficacité dans les applications pratiques (incapacité à "lisser" les pics de températures par exemple).
Mais cette cinétique peut être améliorée par l'introduction de solvants à forte polarité et à forte constante diélectrique au sein du MCP. Ces solvants permettent d'abaisser les tensions superficielles aux niveau des interfaces liquide/solide.
Résistance au transfert thermique
- Lors du changement de phase du MCP, l'échange thermique a lieu à l'interface solide/liquide. Lorsque le front de solidification ou de fusion se déplace, il laisse derrière lui une nouvelle phase (solide ou liquide) que le flux thermique doit traverser avant d'atteindre le front en question. Plus l'épaisseur de cette phase est importante et plus la résistance thermique qu'elle engendre est grande.
Malheureusement, les MCP ont une conductivité thermique assez faible (de l'ordre de 0,15 W/m.K) ce qui empèche d'ores et déjà un bon transfert thermique. Ce phénomène est alors amplifié par l'épaisseur de la phase à traverser. Il faut donc, si l'on souhaite limiter ces phénomènes de résistance dus au déplacement du front thermique, faire en sorte que l'épaisseur à traverser soit la plus petite possible. C'est pour celà que l'on utilise souvent des micro-capsules sphériques qui changent facilement de phase sur l'ensemble de leur volume.
Confinement
- L'encapsulation semble être une bonne solution au confinement des MCP. En effet, lorsque ce dernier est à l'état liquide, il n'a plus de tenue physique et nécessite un contenant. On essaiera, par ailleurs, de maximiser les échanges thermiques par tous les moyens (en choisissant de bons conducteurs thermiques pour la fabrication des capsules par exemple).
Durée de vie ?
- Selon le CSTB[4], les MCP utilisés dans l'habitat auraient une durée de vie égale ou supérieure à celle des bâtiments actuels.
Aspects sanitaires et sécuritaires
- Les MCP étant très diversifiés et peu utilisés à l'heure actuelle, on comprend que peu d'études systématiques aient été faites au sujet de leur impact sanitaire et des risques qu'ils représentent.
- Leur utilisation reste à l'heure actuelle encore limitée par la méconnaissance des comportements de ces matériaux en situation d'incendie. Mais certaines technologies sont maintenant mûres de nos jours. La société Kaplan Energy commercialise déjà dans ses CESI et SSC des accumulateurs thermiques constitués de MCP.
Références
- ↑ (fr) CSTB, « Matériaux à changement de phase : vers une 'climatisation' douce », 06.12.07
- ↑ (en) DUPONT, « Dupont Energain Product Information Sheet », 11.06
- ↑ (fr) CSTB, « Utilisation des MCP en climatisation passive et chauffage d'intersaison », 28.12.2004
- ↑ (fr) CSTB, « Liquides ou solides - Les matériaux à changement de phase », décembre 2006
Bibliographie
- Christophe PLANTIER, Étude numérique et expérimentale d'un prototype de chauffe-eau solaire équipé d'un stockage à chaleur latente, 29 mars 2005
Articles connexes
Liens externes
- (en) Page personnelle d'un doctorant en MCP
- (fr) « Utilisation des Matériaux à Changement de Phase (MCP) en climatisation passive et chauffage d’intersaison », D. Quénard, H. Sallée, K. Johannes, A. Husaunnde.
- Portail des technologies
Catégories : Matériau de construction | Isolant | Thermique du bâtiment
Wikimedia Foundation. 2010.

![=[{1}\times{1392}\times{C_{p_{~MCP~solide}}}\times{(55-30)}]~+~[{1}\times{1392}\times{L_f}]~+~[{1}\times{1279}\times{C_{p_{~MCP~liquide}}}\times{(70-58)}]](/pictures/frwiki/100/d069ef5138ff8798280d1d104c2a7784.png)