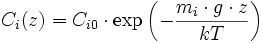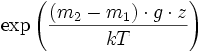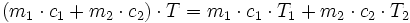- Melange homogene
-
Mélange homogène
Le mélange est l'action de prendre deux composants distincts, deux phases, et de les réunir dans un récipient. La réunion de ces composants peut être accidentelle, ou bien peut avoir pour but d'amorcer une réaction chimique (mise en présence des réactants) ou d'avoir un système ayant les propriétés des deux composants pris individuellement.
On parle de mélange homogène lorsque l'on peut considérer que l'on a un produit unique.
Pour certains, parler de « mélange homogène » est superfétatoire, un pléonasme, puisque le mot « mélange » désigne déjà la réunion de composants différents en un ensemble indissociable d'un point de vue quelconque. Cependant, cette homogénéité n'est pas absolue, mais dépend des paramètres auxquels on s'intéresse. Par exemple, un mélange pourra sembler homogène à l'œil nu, mais pas pour une machine analyse chimique sensible ; l'homogénéité peut-être satisfaisante ou non selon le but de l'opération de mélange ou du mélange lui-même ou encore selon les paramètres de son stockage ou le délai avant son usage.
L'homogénéité peut s'apprécier à l'uniformité des concentrations en tout point du mélange et à l'absence de structures ou micro-structures physiquement décelables, par exemple visuellement. Ainsi un mélange homogène de liquides se reconnaîtra à sa transparence, compte-tenu bien sûr de celles des liquides mélangés.
Lorsque l'on ne peut pas considérer le système obtenu comme étant une phase unique pour l'application concernée, on parle de « mélange hétérogène ».
Du fait de la proximité des composants, un mélange homogène de réactants est toujours plus réactif qu'un mélange hétérogène : la réaction s'amorce plus facilement, elle est plus rapide, elle peut même être violente.
Sommaire
Déroulement d'un mélange
Les constituants d'un mélange sont généralement des produits différents, mais peuvent être un même corps dans des états différents, par exemple
- eau liquide-eau cristallisée ;
- eaux à différentes températures,
- air faiblement humide-air saturée en humidité,
- ....
Lorsque l'on a deux produits différents, ils peuvent différer par :
- leur composition chimique ;
- leur état (gazeux, liquide, solide) et leur température ;
- leurs propriétés physiques (élasticité..., optiques, électromagnétiques...)
Lorsque l'on met ces deux produits en contact, ils peuvent :
- rester sous la forme de deux produits « côte à côte », autrement dit deux phases juxtaposées, on parle de « mélange hétérogène », de « produits non miscibles » ;
- se mélanger pour former une phase homogène, on parle alors de « mélange homogène » et de « produits miscibles » ;
- réagir chimiquement ou physiquement pour former une nouvelle phase unique, ou bien d'autres phases miscibles ou non.
L'obtention d'un mélange homogène passe en général par ue phase d'agitation, de « brassage », afin de forcer le déplacement des éléments des deux phases initiales et de les répartir uniformément. Dans le cas d'une mélange de poudres, on peut aussi passer par une phase de broyage, afin de fractionner les solides, mais ce broyage peut au contraire provoquer une agglomération.
Conditions de miscibilité
Mélanges de gaz
Deux gaz, s'ils ne réagissent pas vivement l'un sur l'autre, sont toujours miscibles, un mélange gazeux est toujours homogène. Un contre-exemple typique est le mélange d'ammoniac (NH3) et de chlorure d'hydrogène (HCl, anhydride d'acide chlorhydrique), qui forme un brouillard de cristaux de chlorure d'ammonium (NH4Cl).
Hors cas de réaction chimique, c'est même le modèle de l'homogénéité : les molécules sont très faiblement liées et le mouvement brownien (diffusion) et tous les autres types de déplacement de matière (convection, courant) sont les plus intenses dans l'état gazeux, assurant le maintien de l'homogénéité.
Le mélange n'est pas toujours spontané ou être pratiquement retardé par des différences de température, la pesanteur et autre effet physique : en l'absence d'agitation, un gaz peut s'accumuler au niveau du sol ou au contraire dans des anfractuosités situées plus en hauteur ; les polluants gazeux ne se diffusent que lentement parfois dans l'atmosphère...
En présence d'un champ de pesanteur et si la hauteur du système considéré est importante, on peut avoir une stratification : la concentration en gaz le plus dense est plus importante en bas (gaz dit « lourd »), et la concentration en gaz le moins dense est plus importante en haut (gaz dit « léger »).
Cet effet ne peut se constater qu'avec des différences d'altitude de plusieurs centaines de mètres. En effet, l'énergie cinétique des molécules de gaz (3·k·T, où k est la constante de Boltzmann et T est la température absolue) est très supérieure à l'énergie potentielle de gravité (mi·g·z, où mi est la masse d'une molécule, g est l'accélération de la gravité et z est l'altitude). La concentration de gaz i Ci(z) suit une loi de Maxwell-Boltzmann
où Ci0 est la concentration à l'altitude de référence (z = 0). On voit que le rapport de proportions C1/C2 varie selon
qui varie très lentement en z.
Par contre, lorsque la température diminue ou que la pression augmente, on peut avoir la condensation d'un des gaz (rosée) ; on se rapproche alors d'un mélange hétérogène appelé aérosol ou brouillard, et le mélange s'appauvrit fortement en gaz qui se liquéfie.
Mélanges de liquides
La composition chimique et les propriétés physiques de deux liquides déterminent leur miscibilité.
Leurs tensions superficielles peuvent empêcher l'homogénéisation. On peut intervenir par agitation (brassage), mais le résultat est le plus souvent une émulsion qui avec le temps reviendra aux phases initiales. L'émulsion revient à fractionner le plus finement possible chaque phase, mais les ordres de grandeur de ces fractionnement sont très loin des dimensions moléculaires ou atomiques : l'émulsion n'est pas un mélange vraiment homogène et cela se constate souvent à l'œil nu (effet vinaigrette).
Les propriétés chimiques des liquides en présence et leurs paramètres physiques peuvent empêcher tout mélange :
- par réactivité : synthèse d'un composé solide (précipitation) ou gazeux (risque d'explosion) ;
- volatilisation d'un liquide proche de son point d'ébullition si l'autre liquide à une température élevée ou que l'on est en présence d'une réaction exothermique ;
- par incompatibilité :
liquide hydrophobe et liquide hydrophile : exemple de l'eau et de l'huile, la solution dans ce cas étant de faire appel à un tiers conciliant les deux autres tel qu'un savon...
En cas de miscibilité, un certain nombre de propriétés extensives suivent une loi dite « des masses » :
- si la propriété A du liquide 1 vaut A1 et que celle du liquide 2 vaut A2,
- et que l'on mélange une masse m1 du liquide 1 avec une masse m2 du liquide 2,
- alors la propriété A du mélange vaut :
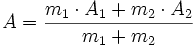
- La valeur de A est la moyenne des valeurs pour chaque liquide pondérée par les masses.
Cependant, cette loi ne s'applique pas à toutes les propriétés extensives pour tous les systèmes. En effet, il peut se produire des réactions chimiques ou physiques modifiant les valeurs ; ainsi, cette loi des masses est en général respectée pour des propriétés telles que le volume ou la capacité calorifique, mais pas toujours. Les propriétés intensives, quant à elles, ne suivent pas une loi de ce type (par exemple la température, la pression... ne suivent pas la loi des masses).
Mélanges liquide/solide
Les propriétés du liquide et du solide permettent parfois d'obtenir l'homogénéité via la dissolution du solide, on a alors une phase unique appelée « solution ». Voir aussi les articles Précipité et Solvant.
Si le solide ne se dissout pas, on peut obtenir une certaine homogénéité dans le mélange d'un liquide et d'un solide en poudre si l'application n'est pas trop « regardante ». La viscosité du liquide et son affinité chimique pour le corps en poudre sont les principaux paramètres de la stabilité du mélange, en plus de la granulométrie.
Le solide peut également lier les molécules du liquide ; c'est le cas par exemple de l'eau et de la farine dans la fabrication d'une pâte en cuisine, de l'eau et du ciment pour la fabrication d'un mortier, de l'eau et du gypse dans la fabrication du plâtre. On obtient alors ce qui semble être un fluide très visqueux, « pâteux », mais qui est en fait une poudre (donc un solide) dont les grains sont liés entre eux par les molécules d'eau. La quantité d'eau doit être suffisante pour hydrater tous les grains de poudre (ne pas faire de grumeau) et pas excessive pour ne pas être en surplus ; dans ces conditions, et si le mélange est bien pétri, on est réellement en présence d'une seule phase (poudre hydratée).
Le mélange sera dit « homogène » s'il paraît uniforme à l'œil et sous la main (absence de grumeaux, on ne sent plus la granulosité), mais observé à la loupe, il sera composé de grains séparés.
Mélanges de solides
Dans le cas de solides, l'homogénéité n'est jamais parfaite, elle est proportionnelle à la finesse de la granulométrie des poudres. On s'attache alors à avoir une répartition aléatoire des grains des deux composants, la granulométrie devant être sensiblement identique pour les deux poudres.
Lorsque l'on passe par une étape de fusion, on en revient alors à la situation de mélange de liquides. Au refroidissement, il peut se produire soit la solidification d'une seule phase, soit la solidification de plusieurs phases, voir l'article Diagramme de phase. Lorsque l'on a formation d'une seule phase, on ne parle pas de mélange homogène mais d'« alliage homogène », ou de « solution solide ». La fusion n'est donc pas à proprement parler une méthode de mélange de solides.
Mélanges solide/gaz et liquide/gaz
Malgré le caractère relatif de la notion d'homogénéité, on considère toujours en physique que l'on est en présence d'un mélange hétérogène.
Cependant, on peut s'attacher à avoir une répartition parfaitement aléatoire (donc statistiquement uniforme), mais on parle plutôt d'uniformité que d'homogénéité.
Température d'un mélange
Dans le cas d'un mélange dit « idéal » de deux liquides (ou de deux gaz) de température T1 et T2, l'énergie calorifique apportée par chacun des liquides est mise en commun. La température finale T peut donc se calculer par :
où ci est la capacité calorifique du liquide i. Dans certains cas, les interactions entre les deux liquides « absorbent » ou au contraire « génèrent » de la chaleur ; cette loi devient donc fausse, et l'écart de chaleur est appelée « enthalpie de mélange ».
Catégorie : Phase
Wikimedia Foundation. 2010.