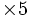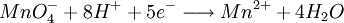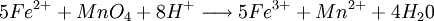- Methode de Bertrand
-
Méthode de Bertrand
La méthode de Bertrand est une méthode biochimique qui permet le dosage des oses réducteurs grâce à un dosage en retour.
Sommaire
Principe
Le glucose réduit partiellement la liqueur de Fehling en excès l’oxyde cuivreux formé (précipité rouge) est dosé par manganimétrie. Une table donne la correspondance entre la masse de cuivre et la masse de glucose. La réaction doit se dérouler à chaud et pendant trois minutes à partir de l'ébullition pour respecter la correspondance des tables.
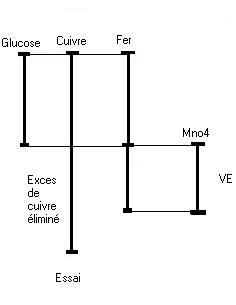
VE : Volume de l'essai
Une quantité de glucose réagit avec le cuivre en excès pour former un précipité rouge brique. L'excès de cuivre est éliminé. Le précipité réagit avec un excès de fer pour le dissoudre. L'excès de fer est donné par une solution de permanganate de potassium.
Protocole
Matériel
-
- burette
- béchers
- 2 erlenmeyers de 100 ml
- agitateurs
- propipette
- pipette de 5 mL
- pipette de 10 mL
- pipette de 20 mL
- pinces
- filtres de porosité 3
- pompe à vide
- fiole à vide
solutions
-
- essai à doser
- liqueur de Fehling
- eau distillée bouillie
- permanganate de potassium à 0,02 mol/l
- thiosulfate de fer à 0,02 mol/l
- acide chlorhydrique concentré (en cas d'hydrolyse de l'essai)
Étapes
- dans un erlen :
- prélever 5 ml de solution à doser (selon ce qui est dosé, faire attention aux dilutions)
- 40 ml de liqueur de Fehling
- 10 ml d'eau distillée bouillie
- porter à ébullition douce pendant 3 minutes exactement
- refroidir sous l'eau le plus rapidement possible
- incliner l'erlen pour rassembler le précipité
- Régler à faible régime voir le détail sur Filtration sous vide
- transvaser le liquide sur le filtre en entraînant le moins possible de précipité
- laver le précipité plusieurs fois a l'eau bouillie jusqu'à disparition de la couleur bleue.
- ne jamais laisser le précipitée au contact de l'air (erlen et filtre)
- préparer la solution de permanganate de potassium dans la burette
- vider et rincer la fiole à vide
- dans l'erlen, verser 20m l de solution ferrique et agiter (dissolution du précipité)
- verser le contenu sur le filtre pour dissoudre le reste du précipité
- laver l'erlen avec 5 ml d'eau bouillie, filtrer
- doser immédiatement la solution ferrique avec le permanganate, la réaction se termine quand la solution passe du vert au rose
Équations de réactions
- oxydation du glucose
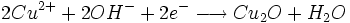
- glucose
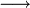 produits d’oxydation + n e-
produits d’oxydation + n e-
- oxydation du Cu2O par les ions Fe3+
- Dosage de Fe2+ par une solution de permanganate titrée
Conditions opératoires
- Le précipité n’est jamais en contact avec l’air pour éviter son oxydation.
- Utiliser de l’eau distillée bouillie pour éviter l’oxydation par le O2 dissout dans l’eau.
- Laver abondamment le précipité pour éliminer le tartrate, sinon le virage avec le permanganate ne sera pas visible.
Le temps d’ébullition est d’exactement 3 minutes pour la correspondance avec les tables.
Relation pour le calcul
1 mole de MnO4- réagissent avec 5 moles de Fe2+
5nMnO4 − = nFe2 +
2 moles de Fe2+ proviennent de 1 mole de Cu2O
nFe2 + = 2nCu2O
1 mole de Cu2O proviennent de 2 moles de Cu2+
2nCu2O = nCu2 +
donc
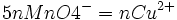
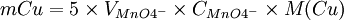
Une fois la masse de cuivre connue, il nous faut utiliser les tables de Bertrand, qui donnent la relation entre la concentration de glucose et celle de précipité de cuivre formé.
Précisions
Il est possible de doser le saccharose par cette méthode. Il faut alors procéder à une hydrolyse en milieu acide pendant 20 minutes à 70 °C. Il faudra utiliser la table des sucres invertis . Le dosage se fait alors en milieu neutre . Neutraliser l’hydrolysat avec de la soude et de la phénolphtaléine. Le dosage des autres sucres réducteurs est possible à condition de connaître les tables pour pouvoir interpréter les résultats.
Si le surnageant après ébullition est jaune ou coloré, il faut diluer la solution.
Si vous dosez le glucose dans un jus de fruits, il faut déféquer avant le dosage.
Pour des dosages du glucose à faible concentration utilisez plutôt la méthode du dosage du glucose par le DNS.
Table de conversion glucose
Table de conversion glucose en mg glucose en mg cuivre en mg glucose en mg cuivre en mg glucose en mg cuivre en mg 10 20,4 40 77,5 70 129,8 11 22,4 41 79,3 71 131,4 12 24,3 42 81,1 72 133,1 13 26,3 43 82,9 73 134,7 14 28,3 44 84,7 74 136,3 15 30,2 45 86,4 75 137,9 16 32,2 46 88,2 76 139,6 17 34,2 47 90,0 77 141,2 18 36,2 48 91,8 78 142,8 19 38,1 49 93,6 79 144,5 20 40,1 50 95,4 80 146,1 21 42,0 51 97,1 81 147,7 22 43,9 52 98,9 82 149,3 23 45,8 53 100,6 83 150,9 24 47,7 54 102,3 84 152,5 25 49,6 55 104,1 85 154,0 26 51,5 56 105,8 86 155,6 27 53,4 57 107,6 87 157,2 28 55,5 58 109,3 88 158,8 29 57,2 59 111,1 89 160,4 30 59,1 60 112,8 90 162,0 31 60,9 61 114,5 91 163,6 32 62,8 62 116,2 92 165,2 33 64,6 63 117,9 93 166,7 34 66,5 64 119,6 94 168,3 35 68,3 65 121,3 95 169,9 36 70,1 66 123,0 96 171,5 37 72,0 67 124,7 97 173,1 38 73,8 68 126,4 98 174,6 39 75,7 69 128,1 99 176,2 100 177,8 Table de correspondance des sucres invertis
Table de correspondance des sucres invertis sucre en mg cuivre en mg sucre en mg cuivre en mg sucre en mg cuivre en mg 10 20,6 40 77,7 70 129,2 11 22,6 41 79,5 71 130,8 12 24,6 42 81,2 72 132,4 13 26,5 43 83,0 73 134,0 14 28,5 44 84,8 74 135,6 15 30,5 45 86,5 75 137,2 16 32,5 46 88,3 76 138,9 17 34,5 47 90,1 77 140,5 18 36,4 48 91,9 78 142,5 19 38,4 49 93,6 79 143,7 20 40,4 50 95,4 80 145,3 21 42,3 51 97,1 81 146,9 22 44,2 52 98,8 82 148,5 23 46,1 53 100,6 83 150,0 24 48,0 54 102,5 84 151,6 25 49,8 55 104,0 85 153,2 26 51,7 56 105,7 86 154,8 27 53,6 57 107,4 87 156,4 28 55,5 58 109,2 88 157,9 29 57,4 59 110,9 89 159,5 30 59,3 60 112,6 90 161,1 31 61,1 61 114,3 91 162,6 32 63,0 62 115,9 92 164,2 33 64,8 63 117,6 93 165,7 34 66,7 64 119,2 94 167,3 35 68,5 65 120,9 95 168,8 36 70,3 66 122,6 96 170,3 37 72,2 67 124,2 97 171,9 38 74,0 68 125,9 98 173,4 39 75,0 69 127,5 99 175,0 100 176,5 Utilisation des Tables de Bertrand
Il n'y a pas de proportionnalité entre les masses de cuivre formé et le glucose (ou les sucres).On ne peut donc pas utiliser le produit en croix. De plus, on trouve rarement une masse de cuivre qui est écrite dans le tableau.
Dans l'exemple suivant, on trouve une masse de cuivre de 22 mg
sucre en mg cuivre en mg 10 A 20,6 D x B 22,0 E 11 C 22,6 F 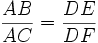
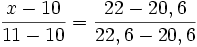
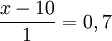
x − 10 = 0,7
x = 10 + 0,7
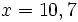 mg de glucose
mg de glucose
Attention : ne pas oublier de tenir compte des dilutions pour retrouver la concentration en glucose de la solution initiale !voir aussi
- Portail de la chimie
Catégories : Méthode de la biochimie | Technique de laboratoire | Chimie analytique -
Wikimedia Foundation. 2010.

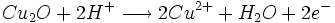
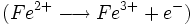
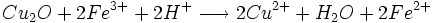
![[Fe^{2+} \longrightarrow Fe^{3+} + e^-]\,](/pictures/frwiki/55/7d82d2dfd276c65faef785b2872d8b05.png)