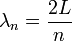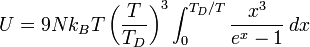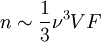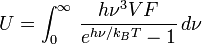- Modele de Debye
-
Modèle de Debye
En physique statistique et en physique du solide, le modèle de Debye est une explication, développée par Peter Debye en 1912[1], du comportement de la capacité thermique des solides en fonction de la température. Il consiste à étudier les vibrations du réseau d'atomes formant le solide, autrement dit, les phonons.
Ce modèle permet d'expliquer précisément les relevés expérimentaux, alors que le modèle d'Einstein, basé sur la notion d'oscillateur harmonique quantique, présentait une légère différence. Le modèle de Debye rejoint également la Loi de Dulong et Petit à haute température.
Sommaire
Obtention
Le modèle de Debye est analogue à l'obtention de la loi de Planck sur le rayonnement du corps noir. Le second traîte un ensemble de photons, alors que le premier traîte un ensemble de phonons.
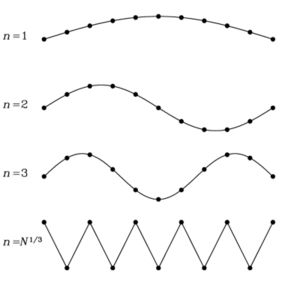
On suppose, pour simplifier, que le solide a une forme cubique de côté L. Les phonons susceptibles d'exister doivent, à la manière de la vibration d'une corde de guitare, ne pas vibrer aux extrémités (voir figure ci-contre). On en déduit alors que les longueurs d'ondes possibles sont données par :
où n est un entier naturel non-nul.
Or l'énergie d'un phonon est donnée par :
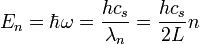 avec
avec 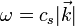
où
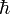 est la constante de Planck,
est la constante de Planck, 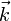 le vecteur d'onde du phonon, et cs sa vitesse.
le vecteur d'onde du phonon, et cs sa vitesse.Cela correspond, en trois dimensions, à l'expression :
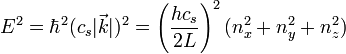 .
.
Il est alors possible de faire la somme de ces énergies pour tous les phonons présents. Pour cela, il faut utiliser la statistique de Bose-Einstein, donnant la distribution des énergies dans l'ensemble des phonons, à la température T. On obtient finalement l'expression suivante de l'énergie totale U des phonons :
où N est le nombre d'atomes dans le solide considéré, kB est la constante de Boltzmann, et TD est la température de Debye donnée par :
![T_D = {hc_s\over2Lk_B}\sqrt[3]{6N\over\pi}](/pictures/frwiki/101/eaf26b75efdee3884a693944f9547061.png) .
.
La capacité thermique molaire est alors, par définition, la dérivée de U par rapport à T. On obtient :
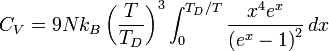
Obtention de Debye
En réalité, Debye a obtenu cette formule d'une façon un peu différente, et plus simple. En utilisant la mécanique des milieux continus, il montra que le nombre d'états vibrationnels accessibles aux phonons en-dessous d'une fréquence ν est donné approximativement par :
où V est le volume du solide et F est un facteur calculé à l'aide des coefficients d'élasticité (comme le module d'Young).
En combinant cela à l'énergie d'un oscillateur harmonique (méthode déjà utilisée dans le modèle d'Einstein), on obtiendrait une énergie totale :
Mais il ne peut pas y avoir plus d'états vibrationnels que les N atomes peuvent fournir, c'est-à-dire 3N (car il y a trois degrés de liberté de vibration par atome). Ainsi, l'intégrale de la formule précédente doit être calculée jusqu'à une fréquence maximale νmax telle que le nombre d'états total soit 3N. C'est-à-dire :
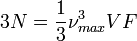 .
.
La formule donnant l'énergie est donc :
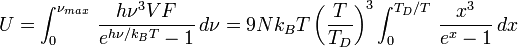 .
.
On retrouve bien l'expression obtenue plus haut, avec une température TD d'expression différente. On peut vérifier aussi que les deux expressions de TD sont cohérentes avec la mécanique des milieux continus.
Résulats du modèle
Limite des basses températures
Lorsque la température est faible devant TD, l'expression de CV se simplifie :
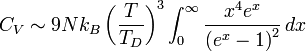 .
.
Cette intégrale peut être calculée, ce qui donne :
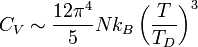
Les relevés expérimentaux correspondent bien à ce comportement.
Limite des hautes températures
Lorsque la température est grande devant TD, l'expression de CV se simplifie une fois encore :
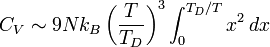 .
.
D'où :
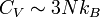
On retrouve ainsi la loi de Dulong et Petit, qui est relativement bien vérifiable par l'expérience, sauf lorsque l'anharmonicité des vibrations fait remonter la valeur de CV. De plus, il peut être intéressant d'ajouter la contribution des électrons à cette capacité thermique.
Comparaison au modèle d'Einstein
Les modèles d'Einstein et de Debye donnent des résultats relativement proches, mais celui de Debye est valable aux basses températures alors que celui d'Einstein ne l'est pas.
Références
- ↑ 'Zur Theorie der spezifischen Warmen', Annalen der Physik 39(4), p. 789 (1912)
Voir aussi
Articles connexes
Liens externes
- Portail de la physique
Catégories : Physique du solide | Physique statistique
Wikimedia Foundation. 2010.