- Neuroglobine
-
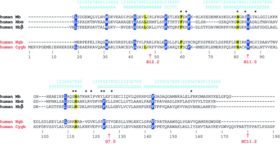 Comparaison entre les séquences des globines.
Comparaison entre les séquences des globines.
La neuroglobine est une globine de stockage et de transport de l'oxygène dans le système nerveux. À ce titre, elle présente beaucoup d'analogies avec la myoglobine: structure monomérique, forte affinité pour l'oxygène. Ainsi, la neuroglobine facilite le transport d'oxygène vers les mitochondries des cellules nerveuses et joue un rôle fondamental dans la protection des neurones en conditions d'hypoxie.Sommaire
Découverte de la neuroglobine
L'existence d'une globine dans les cellules nerveuses était connue chez certains invertébrés (mollusques et vers notamment) mais n'avait pas été mise en évidence jusque-là chez les animaux supérieurs. La façon dont a été découverte la neuroglobine est particulièrement intéressante et illustre bien une nouvelle approche de la recherche en physiologie basée sur l'étude du génome.
En effet, pour chercher l'existence d'une telle globine, les chercheurs de l'institut de zoologie et du département de génétique moléculaire de l'université de Mayence en Allemagne ont travaillé à partir de banques de données donnant le séquençage de fragments d'ADN humains et murins[1]. Connaissant la structure des gènes de l'hémoglobine et de le myoglobine, ils ont recherché dans les banques de données, les séquences d'ADN présentant des analogies avec ces gènes. À partir de ces séquences d'ADN, ils ont pu cloner et séquencer un gène humain porté par le chromosome 14 et codant une protéine de 151 acides aminés, appartenant à la famille des globines, mais distincte de l'hémoglobine et de la myoglobine. Le gène murin correspondant a aussi pu être identifié et présente un taux d'identité de 94% avec son analogue humain.Expression du gène de la neuroglobine
Par plusieurs techniques d'hybridation moléculaire, les chercheurs de l'université de Mayence ont pu rechercher l'ARN messager produit par le gène de la neuroglobine dans différents tissus. ainsi l'expression de ce gène a été mise en évidence au niveau du cerveau, principalement au niveau du lobe frontal, dans le thalamus et les noyaux sous-thalamiques. Par ailleurs, l'expression de ce gène était plus faible (10 à 20%) dans le côlon, les poumons, ou même minime (<10%) ou absente d'autres tissus. Ainsi cette globine était essentiellement présente dans le système nerveux, les auteurs lui ont attribué le nom de neuroglobine [1].
Rôle physiologique de la neuroglobine
Fixation réversible de l'oxygène
La purification de la neuroglobine par chromatographie à partir de cerveaux de souris, montre qu'elle existe dans le cytosol neuronal sous forme de monomères[2]. l'étude des neuroglobines recombinantes (dont l'obtention est plus facile que par purification), montre qu'elles fixent l'oxygène de manière réversible, ce qui est une propriété générale pour la plupart des globines. L'affinité à l'oxygène pour la neuroglobine (la pression en oxygène à 50% de saturation (P50) = 1 à 2 torr) est beaucoup plus élevée que celle pour l'hémoglobine (26 torr) et semblable à celle de la myoglobine (1 torr) [1]. Contrairement à la myoglobine, dans la neuroglobine la sixième position de coordination avec l'atome de fer hémique est occupée par une histidine (HisE7). Cette particularité structurale est liée à une fonction spécifique encore inconnue[3].
L'étude spectroscopique montre que l'O2 et le CO se lient à la neuroglobine par un mécanisme en trois étapes:
 (L est soit O2 ou CO)
(L est soit O2 ou CO)
La première dissociation entre Fe et l'HisE7 (ligand endogène) constitue l'étape limitante (Koff = entre 4.5 et 8.2 x 10³ / s). Par contre, la constante d'association du premier ordre entre le Fe et L est importante (Kon = entre 1,3 et 2,5 x 10⁸ / s). Les affinités apparentes des ligands exogènes (O2 et CO) semblent identiques à celles obtenus avec la myoglobine et les chaînes isolées α et β de l'hémoglobine [4].
Neuroglobine et hypoxie
En faveur de sa propriété de fixer de façon réversible l'oxygène, on peut remarquer que les zones cérébrales où l'expression de la neuroglobine est relativement faible sont plus sensibles à l'hypoxie alors que celles où son expression est plus élevée sont plus résistantes. Par exemple, la durée moyenne de l'ischémie nécessaire pour produire la moitié du dégât maximal est de 19,1 min pour le cortex cérébral et de 12,7 min pour l'hippocampe, et l'expression de la neuroglobine dans le cortex cérébral est environ 4 fois plus élevée que dans l'hippocampe. La sensibilité de l'hippocampe à l'hypoxie peut expliquer chez l'homme, parmi les séquelles d'accidents ischémiques sévères ou d'intoxication au CO, les troubles de mémoire[5].
Les résultats obtenus par l'équipe de l'Institut Buck de recherche sur le vieillissement (Californie, USA) soutiennent la notion que la neuroglobine assure une fonction de transport facilité et de stockage de l'oxygène dans les neurones. Cette équipe a étudié l'effet de la privation d'oxygène sur la viabilité cellulaire de neurones murins en culture en utilisant des marqueurs de la fonction mitochondriale, d'intégrité de la membrane et d'activation de mort cellulaire. De façon très significative, les conséquences cellulaires de l'hypoxie ont été plus importantes pour les neurones dont la synthèse de la neuroglobine a été inhibé à 50% par un ARN anti-sens. Inversement, la surexpression du gène de la neuroglobine par transfection est accompagnée d'une meilleure viabilité cellulaire dans les conditions d'hypoxie [6].
La neuroglobine s'est avérée avoir un effet spécifique sur l'agression provoquée par l'hypoxie et n'a pas montré d'action générale de protection cellulaire. En effet, le blocage de son expression et sa surexpression ce sont montrés sans effet sur les marqueurs de viabilité de cellules soumises à d'autres agents ayant une toxicité cellulaire comme la staurosporine ou le nitroprussiate de sodium, un donneur de monoxyde d'azote.
Références
- Burmester T., Weich B., Reinhardt S., & Hankeln T., (2000). A vertebrate globin expressed in the brain. Nature 407; 520-523.
- Zhang C., Wang C., Deng M., et al., (2002). Full-length cDNA cloning of human neuroglobin and tissue expression of rat neuroglobin. Biochemical and Biophysical Research Communications 290; 1411-9.
- Trent J.T., Watts R.A., and Hargrove M.S., (2001). Human neuroglobin, a hexacoordinate hemoglobin that reversibly binds oxygen. J. Biol. Chem. 276; 30106–30110.
- Dewilde S., Kiger L., Burmester T., Hankeln T., Baudin-Creuza V., Aerts T., Marden M.C., Caubergs R. and Moens L., (2001). Biochemical characterization and ligand binding properties of neuroglobin, a novel member of the globin family. J. Biol. Chem. 276; 38949–38955.
- Belmin J., Pariel-Madjlessi, Onen F., (2001). Oxygène et troubles de la mémoire liés au vieillissement. Paris, Pill Editions.
- Sun Y., Jin K., Mao XO., Zhu Y., Greenberg DA., (2001). Neuroglobin is up-regulated by and protects neurons from hypoxic-ischemic injury. Proc Natl Acad Sci USA. 98(26); 15306-15311.
Liens internes
- Super famille des hémoprotéines.
- Famille des globines : hémoglobine, myoglobine, neuroglobine, cytoglobine.
- Structure des globines : peptide, hème, porphyrine, liaison de coordination, fer.
- Accidents Ischémiques : ischémie, hypoxie, asphyxie, infarctus du myocarde, accident vasculaire cérébral, monoxyde de carbone (CO), intoxication au CO, nécrose celluaire, gènes pro-apoptotiques, apoptose.
Documentation
- Cours et articles
- [PDF] Transport de l'oxygène dans le sang: Cours.
- [PDF] Neuroglobin protects the brain from experimental stroke in vivo: Article fondamental.
- [PDF] Neuroglobin and cytoglobin, Fresh blood for the vertebrate globin family: Article de revue.
- Banques de données biologiques
- Crystal structure of Human brain neuroglobin : Structure 3D et modèle interactif (java) de la neuroglobine par la Protein Data Bank (RCSB PDB). Attention: Si ce lien ne fonctionne pas, effectuez vous même une recherche sur ce site avec le mot clé neuroglobin.
- Q9NPG2 Human neuroglobin gene (Swiss-Prot) : Séquence compléte et autres informations sur le gène humain de la neuroglobine (NGB) par la Swiss-Prot.
- Pubmed: Pour consulter l'actualité biologique et médicale sur ce sujet NLM.
Liens externes
Wikimedia Foundation. 2010.

