- Archébactérie
-
Archaea
Archées
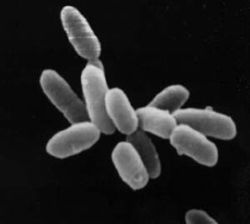
Halobacterium sp. souche NRC-1.
Chaque cellule a environ 5 μm de longueur.Domaine Archaea
Woese, Kandler & Wheelis, 1990Classes de rang inférieur - phylum Crenarchaeota
- classe Thermoprotei
- phylum Euryarchaeota
- classe Halobacteria
- classe Methanobacteria
- classe Methanococci
- classe Methanopyri
- classe Archeoglobi
- classe Thermoplasmata
- classe Thermococci
- phylum Korarchaeota
- phylum Nanoarchaeota
Parcourez la biologie sur Wikipédia : Les Archées ou Archaea (anciennement archéobactéries ou bien encore archébactéries, du grec archaios, « ancien » et backterion, « bâton ») forment un groupe de micro-organismes unicellulaires et sont un groupe majeur de procaryotes. Comme les bactéries, elles ne présentent donc ni noyau, ni organites intracellulaires. Avant les travaux de phylogénie, les Archaea, qui étaient encore appelées archéobactéries, faisaient partie du règne des monères dans la classification du vivant en cinq Règnes. Les analyses plus détaillées ont montré que les archées étaient aussi différentes des Bactéries que celles-ci le sont des Eucaryotes : ces travaux aboutirent à la classification du vivant en trois domaines. Les Archaea ont été ultérieurement divisées en quatre phyla, dont les deux groupes des Crenarchaeota et des Euryarchaeota qui sont les plus étudiés.
Sommaire
Descriptif
Habituellement, la taille et la forme des archées sont similaires à celles des bactéries, bien que certaines espèces d’archées présentent une forme inhabituelle, comme Haloquadra walsbyi qui est de forme plate et carrée. En dépit de ces similarités visuelles avec les bactéries, les archées s’en distinguent par certains caractères biochimiques, comme la constitution de la membrane cellulaire. De plus, elles présentent des gènes et des voies métaboliques qui sont plus similaires à ceux qui sont rencontrés chez les eucaryotes, notamment les enzymes impliquées dans le mécanisme de réplication de l'ADN, la transcription et la traduction. Les archées utilisent une plus grande variété de source d’énergie que les eucaryotes : composé organique comme les sucres, l’ammoniac, les ions métalliques et même l’hydrogène gazeux comme nutriments. Les Halobacteria utilisent la lumière solaire comme source d’énergie, et certaines espèces d’archées peuvent fixer le carbone, cependant, à l’inverse des plantes et des cyanobactéries, il n’y a pas d’espèces d’archées connues capables de réaliser ces deux phénomènes. Les Archaea se reproduisent de manière asexuée et se divisent par fission binaire, fragmentation ou bourgeonnement. Par opposition aux bactéries et aux eucaryotes, aucune espèce d’archées identifiée à ce jour n’est capable de former des spores.
Les Archaea sont extrêmement diversifiées. Certaines sont connues pour leur capacité à vivre dans des conditions extrêmes et occupent des niches écologiques qu'elles sont souvent seules à occuper (pH proche de 0, température supérieure à 100°C, salinité élevée par exemple), mais il existe beaucoup d’archées vivant dans des biotopes plus courants et très variés comme le sol, les lacs, la mer ou l’intestin des animaux. Elles contribueraient jusqu'à 20% du total de la biomasse [1]. Ces procaryotes sont maintenant ainsi reconnus comme une part majeure du vivant sur Terre, ils peuvent jouer un rôle dans le cycle du carbone et le cycle de l'azote. Il n’y a pas d’exemple clairement reconnu d’archées pathogènes ou parasites, mais il existe des espèces mutualistes ou commensales. Par exemple, les archées méthanogènes du tractus intestinal de l’Homme et des ruminants participent à la digestion des aliments. Les archées ont également une importance en technologie, avec par exemple l’utilisation des méthanogènes pour produire des biogaz ou leur participation au traitement des eaux usées. Par ailleurs, les enzymes des archées extrémophiles, résistantes aux températures élevées et aux solvants organiques, sont exploitées en biotechnologie.
Classification
Un nouveau domaine
Au début du XXe siècle, les procaryotes étaient considérés comme un seul groupe d'organismes et classées en fonction de leur biochimie, de leur morphologie et du métabolisme. Par exemple, les microbiologistes essayaient de classer les micro-organismes sur la base des structures de leurs parois cellulaires, leurs formes, et les substances qu'ils consomment. Cependant, une nouvelle approche a été proposée en 1965 qui permet d’étudier les liens de parentés entre les procaryotes en utilisant les séquences des gènes de ces organismes. Cette approche, connue sous le nom de la phylogénétique, est la principale méthode utilisée aujourd'hui.
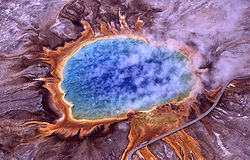 Les Archaea ont d’abord été découvertes dans les environnements extrêmes, comme les sources chaudes volcaniques.
Les Archaea ont d’abord été découvertes dans les environnements extrêmes, comme les sources chaudes volcaniques.
Les Archaea ont d'abord été classées comme un groupe distinct des procaryotes en 1977 par Carl Woese (professeur à l'Université de l'Illinois à Urbana aux États-Unis) et George E. Fox dans les arbres phylogénétiques basées sur les séquences de l’ARN ribosomique 16S (ARNr) des gènes[2]. Ces deux groupes ont été initialement nommé le Eubactéries et Archaeobactéries et traités comme sous-règne ou règne. Woese fait valoir que ce groupe de procaryotes est fondamentalement différent des bactéries. Pour souligner cette différence, et pour insister sur le fait qu’ils composent avec les eucaryotes trois domaines bien distincts du vivant, ces deux domaines ont plus tard été renommé Archeae et Bacteria[3]. Le mot archées vient du grec ancien ἀρχαῖα, qui signifie «choses anciennes».
Dans un premier temps, seuls les méthanogènes ont été placés dans ce nouveau domaine, et les archées ont été considérées comme des extrêmophiles qui n'existent que dans les habitats tels que les sources chaudes et les lacs salés. À la fin du 20e siècle, les microbiologistes se sont rendu compte que les archées sont en fait un grand groupe diversifié d'organismes qui sont très répandues dans la nature et qui sont communs dans une diversité d’habitats, tels que les sols et les océans[4]. Cette nouvelle appréciation de l’importance et de l'ubiquité des archées a été rendu possible grâce à la réaction en chaîne par polymérase pour détecter les procaryotes dans des échantillons d'eau ou de sol à partir de leurs acides nucléiques. Cela permet la détection et l'identification d'organismes qui ne peuvent pas être cultivés en laboratoire, ou dont la culture est difficile[5][6].
Classification actuelle
Ces organismes ont longtemps été regroupés sous le terme générique de procaryotes, avec les bactéries. Pour les différencier, les microbiologistes avaient élaboré un système de comparaison et de classification fondé sur de petites différences visibles au microscope, ainsi que sur des différences physiologiques (capacité à se développer sur un certain milieu par exemple).
Dès qu'il a été question d'élucider les relations généalogiques entre les différents procaryotes, les biologistes ont dû se rendre à l'évidence : les différences nutritionnelles et phénotypiques ne permettraient pas de classer correctement les différents organismes. Au cours des années 1970, les biologistes ont pris conscience de l'existence irremplaçable d'information, au cœur même des cellules des êtres vivants, permettant de déterminer la phylogénie, l'ADN. Le gène identifié dans une cellule est le variant d'un gène qui a existé il y a de très nombreuses années. La comparaison gène à gène entre deux organismes permet donc de mesurer le temps écoulé depuis la divergence à partir de l'ancêtre commun.
Carl Woese a réalisé que l'ARN ribosomique (ou ARNr, une des molécules contenues dans la cellule) des organismes qu'il étudiait permettait de mettre en évidence l'existence de deux groupes clairement séparés : les bactéries et les archéobactéries. En réalité, Woese s'est également rendu compte que les ARNr des archées étaient en fait aussi différents des ARNr des bactéries que de celui des eucaryotes. Il en a conclu qu'il ne fallait plus uniquement séparer en deux grands groupes le monde du vivant, en fonction de la présence ou de l'absence d'un noyau, mais plutôt en trois domaines primitifs : les bactéries, les archées et les eucaryotes.
Aujourd'hui, de nombreuses études ont confirmé le caractère monophylétique de ce groupe. Ces microorganismes ressemblent par leur forme aux bactéries, mais d'un point de vue moléculaire, si certains de leurs traits les rapprochent des bactéries, d'autres les rapprochent plutôt des eucaryotes. Il n'est donc pas possible de voir les archées comme étant des ancêtres des bactéries.
Le classement des archées, et des procaryotes en général, est à la fois en évolution rapide et un domaine litigieux. Sur la base de critères uniquement métaboliques, les archées ont été divisées en quatre grands groupes : les archéobactéries méthanogènes, les archéobactéries halophiles, les archéobactéries thermophiles, les archéobactéries sulfo-dépendantes.
Les systèmes de classification actuelles visent à organiser les archées en groupes d'organismes qui partagent des caractéristiques structurelles et des ancêtres communs[7]. Ces classifications s'appuient fortement sur l'usage de la séquence des gènes de l'ARN ribosomique pour révéler les relations entre les organismes (phylogénétique moléculaire) [8]. La plupart des archées cultivables sont membres de deux principaux embranchements : Euryarchaeota et Crenarchaeota. D'autres groupes ont été provisoirement créé. Par exemple, les espèces propres Nanoarchaeum equitans, qui a été découvert en 2003, a été classé dans un nouveau phylum : Nanoarchaeota [9]. Un nouveau phylum Korarchaeota a également été proposé, il contient un petit groupe d'espèces thermophiles inhabituels qui partagent les caractéristiques des deux principaux embranchements, mais qui est plus étroitement liée aux Crenarchaeota [10][11]. Récemment mises en évidence, d'autres espèces d'archées sont seulement de loin lié à aucun de ces groupes, tels que les Archaeal Richmond Mine Acidophilic Nanoorganisms (ARMAN), qui ont été découvertes en 2006 [12].
Origine et évolution
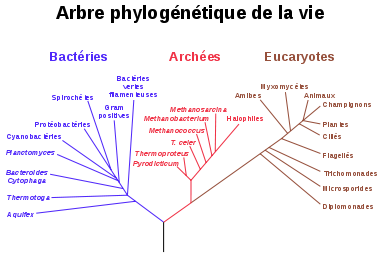
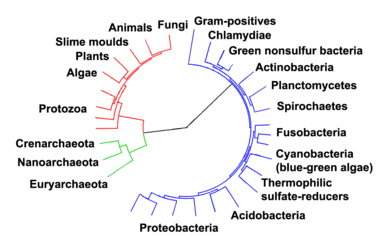 Arbre phylogénétique montrant la relation entre les archées et les autres formes de vie. Les eucaryotes sont de couleur rouge, les archées de couleur verte et les bactéries en bleu. Adapté de Ciccarelli et al..[13]
Arbre phylogénétique montrant la relation entre les archées et les autres formes de vie. Les eucaryotes sont de couleur rouge, les archées de couleur verte et les bactéries en bleu. Adapté de Ciccarelli et al..[13]
Bien que les fossiles connues de cellules procaryotes ont été datés de près de 3,5 milliards d'années, la plupart des procaryotes n'ont pas de morphologies distinctives et les formes des fossiles ne peuvent pas être utilisées pour les identifier comme étant des Archaea[14]. Par contre, les fossiles chimiques, sous la forme des lipides caractéristiques des archées, donnent plus d'informations, car ces composés n’existent pas dans d'autres groupes d'organismes[15]. Certaines publications ont suggéré que des lipides fossiles provenant de procaryotes ou d’eucaryotes étaient présents dans les schistes datant de 2,7 milliards d'années[16], ces données ont depuis toutefois été soumises à question[17]. Ces lipides ont également été détectés dans les roches datant du précambrien. Les plus anciennes traces connues de ces lipides isopréniques proviennent des roches de la formation d'Isua à l'ouest du Groenland, qui comprennent des sédiments formés il y a 3,8 milliards d'années et qui sont les plus anciens sur Terre[18].
 Arbre phylogénétique basé sur l'analyse comparative des gènes ARNr montrant la séparation des bactéries, des archaea, et des eucaryotes.
Arbre phylogénétique basé sur l'analyse comparative des gènes ARNr montrant la séparation des bactéries, des archaea, et des eucaryotes.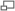
Woese propose que les bactéries, les archées et les eucaryotes représentent chacune une lignée séparée qui aurait divergé à partir d’une colonie d'organismes ancestrale [19][20]. D’autres biologistes, cependant, ont fait valoir que les archées et les eucaryotes proviennent d'un groupe de bactéries[21]. Il est possible que le dernier ancêtre commun des bactéries et des archées soit un organisme thermophile, ce qui soulève la possibilité que la vie soit apparue dans des conditions de températures élevées[22]. Cette hypothèse n’est toutefois pas approuvé par l’ensemble de la communauté scientifique[23] [24]. Par ailleurs, étant donné que les archées et les bactéries ne sont pas plus liées entre elles qu'elles ne le sont des cellules eucaryotes, cela conduit à l'argument selon lequel le terme procaryote a pas de véritable signification évolutive et devrait être entièrement rejeté [25].
La relation entre les archées et les eucaryotes reste une problématique importante. En plus des similitudes dans la structure cellulaire et les mécanismes biochimiques qui sont discutés ci-dessous, de nombreux arbres phylogénétiques groupent les archées et les eucaryotes ensemble. Certaines des premières analyses ont même suggéré que la relation entre les eucaryotes et les archées de l’embranchement Euryarchaeota est plus proche que la relation entre les embranchements Euryarchaeota et Crenarchaeota[26]. Toutefois, il est maintenant considéré comme plus probable que l'ancêtre des eucaryotes a divergé tôt à partir de l’ancêtre commun avec les Archaea[27][28]. La découverte de gènes provenant d’archées dans le génome de certaines bactéries, telles que Thermotoga maritima, rend les relations entre organismes encore plus difficiles à déterminer, étant donné que le transfert horizontal de gènes a eu lieu [29]. Les gènes archéens dans les génomes eucaryotes pourraient également provenir de transfert horizontal. Certains auteurs suggèrent que les eucaryotes se sont développés à partir d’une fusion entre des bactéries et des archées (théorie endosymbiotique)[30].
Génome et Génétique
Les Archaea ont généralement un seul chromosome circulaire. Le plus grand génome archéen séquencé à ce jour est celui de Methanosarcina acetivorans[31] avec 5 751 492 paires de bases alors que le génome de Nanoarchaeum equitans, le plus petit séquencé à ce jour fait un dixième de cette taille avec seulement 490 885 paires de base. Il est estimé que le génome de Nanoarchaeum equitans comporte 537 gènes codant des protéines[32]. Les éléments extrachromosomiques, appelés plasmides sont également présents dans archées. Ces plasmides peuvent être transférés entre les cellules par contact physique, dans un processus qui pourrait être similaire à la conjugaison bactérienne[33][34].
Reproduction
La reproduction des archaea a lieu de manière asexuée par division binaire, par fission multiple ou par fragmentation. La méiose ne se produit pas, tous les descendants ont le même matériel génétique. Après la réplication de l’ADN les chromosomes sont séparés et la cellule se divise[35]. Les détails du cycle cellulaire des archées ont fait l'objet de quelques études dans le genre Sulfolobus. Ce cycle a des caractères qui sont similaires à la fois des systèmes eucaryotes et bactériens. Selon les espèces d’archées, les chromosomes sont répliqués à partir de un ou plusieurs points de départ (origines de réplication) à l'aide d'ADN polymérases qui ressemblent aux enzymes équivalentes des eucaryotes[36]. Toutefois, les protéines de la division cellulaire, tels que la protéine FtsZ, qui forme un anneau contractant autour de la cellule, et les composants de la cloison naissante dans le coeur de la cellule, sont similaires à leurs équivalents bactériens[35].
S’il existe des spores chez les bactéries et les eucaryotes, elles n’ont jamais été mises en évidence dans toutes les archées connues. Certaines espèces de Haloarchaea peuvent subir des modifications phénotypiques et croître avec différents types de cellules, incluant des parois épaisses. Ces structures qui sont résistantes aux chocs osmotiques permettent aux archées à survivre dans l'eau à de faibles concentrations en sel, mais ce ne sont pas des structures de reproduction et elle ne peuvent aider à la dispersion dans de nouveaux habitats[37].
Diversité des Archaea, Habitat
Caractéristiques cellulaires
 Archaea vivant dans les geysers de Yellowstone
Archaea vivant dans les geysers de Yellowstone
Les Archaea sont très diverses, aussi bien d'un point de vue morphologique que physiologique. Ce sont des êtres unicellulaires avec une taille variant entre 0,1 et 15 µm, mais certains se développent pour former des filaments ou des agrégats (filaments jusqu'à 200 µm). Elles peuvent être sphériques (coques), spirales, en forme de bâtonnet, rectangulaires...
Elles font preuve d'une grande diversité de modes de reproduction, par fission binaire, bourgeonnement ou fragmentation.
Métabolisme
D'un point de vue nutritionnel, elles se répartissent en de très nombreux groupes, depuis les chimiolithoautotrophes (tirant leur énergie de gradients chimiques d'origine non biologique) aux organotrophes.
D'un point de vue physiologique, elles peuvent être aérobies, anaérobies facultatives ou strictement anaérobies.
Habitat
Les archées existent dans une large diversité d'habitats, et sont une composante importante des écosystèmes de la planète[4]. Elles peuvent contribuer jusqu'à 20% de la biomasse totale sur la Terre[38]. De nombreuses archées sont extrêmophiles, d’ailleurs, historiquement, les milieux extrêmes étaient considérés comme leurs niches écologiques [réf. nécessaire]. En effet, certaines archées survivent à des températures élevées, souvent supérieures à 100 ° C, que l'on rencontre dans les geysers, les fumeurs noirs, et des puits de pétrole. D'autres se trouvent dans des habitats très froids et d'autres en milieu très salé, acide, ou dans l'eau alcaline. Toutefois, d'autres espèces d’archées sont mésophiles et poussent dans des conditions beaucoup plus douce, dans les marais, les eaux usées, les océans et les sols[4].
Les archées extrêmophiles sont membres des quatre principaux groupes physiologiques. Ce sont les halophiles, thermophiles, alcalophiles et acidophiles[39]. Ces groupes n’ont pas de lien avec leur embranchement dans la classification phylogénétique. Néanmoins, ils sont un point de départ utile pour la classification.
Les halophiles, comme par exemple le genre Halobacterium, vivent dans des environnements salins, tels que les lacs salés (Grand Lac Salé de l’Utah), le littoral marin, les marais salants, la Mer Morte, avec des concentrations en sel jusqu'à 25%. Les membres de l'ordre des Halobacteriales (Haloferax, Halobacterium, Halococcus, Halorubrum, Natrinema, Natronococus...) sont des exemples d’archées halophiles. Elles ont souvent une pigmentation rouge à jaune à cause des caroténoïdes et sont responsables de la coloration de certains lacs (Lac Magadi au Kenya par exemple).
Les thermophiles se développent mieux à des températures supérieures à 45 ° C, dans des lieux tels que les sources d'eau chaude ; les archées hyperthermophiles sont définies comme celles qui se développent au mieux à une température supérieure à 80 ° C[40]. Pyrococcus, Methanopyrus, Thermococcus, Sulfolobus, Pyrodictium sont des exemples d’archées hyperthermophiles. Pyrobaculum provient de réservoirs profonds de pétrole chaud. Pyrolobus fumarii est capable de se multiplier jusqu'à 113 °C. Une étude récente à montré que la souche 116 de Methanopyrus kandleri pousse à 122 ° C, ce qui est la plus haute température enregistrée au cours de laquelle un organisme se développer[41]. D’autres archées peuvent croître dans des conditions très acides ou alcalines[39]. Par exemple, l'une des archées acidophiles les plus extrêmes est Picrophilus torridus, qui croît à un pH de 0, ce qui équivaut à 1,2 molaire d'acide sulfurique[42].Récemment, plusieurs études ont montré que les archées existent non seulement dans les environnements mésophile et thermophile, mais sont également présentes, parfois en grand nombre, à basse température. Par exemple, les archées sont communes dans les environnements froids océaniques telles que les mers polaires[43]. Les archaea sont en fait présentes en grand nombre dans tous les océans du monde dans la communauté planctonique (dans le cadre du picoplancton)[44]. Bien que ces archaea puissent représenter jusqu'à 40% de la biomasse microbienne, presque aucune de ces espèces n’a été isolée et étudiée en culture pure[45]. Par conséquent, notre compréhension du rôle des archées dans l'écologie des océans est rudimentaire, de sorte que leur influence sur les cycles biogéochimiques mondiaux reste largement inexploré[46]. Certaines Crenarchaeota marines sont capables de nitrification, suggérant que ces organismes ont un rôle important dans le cycle de l'azote océanique[47], bien qu’elles peuvent également utiliser d'autres sources énergétique[48]. Un grand nombre d’archées sont également présents dans les sédiments qui recouvrent le fond de la mer, et constitueraient la majorité des cellules vivantes à des profondeurs de plus de 1 mètre dans ces sédiments[49][50]. Les archéobactéries méthanogènes (productrices de méthane) des marais sont responsables des gaz des marais (Poitevin par exemple). Beaucoup d’Archées méthanogènes sont rencontrées dans le tube digestif des ruminants (Methanomicrobium, Methanosarcina), des termites ou des humains.
Archées et santé humaine
Jusqu'à aujourd'hui, il n'y a pas de démonstration claire qu'il existe des archées pathogènes[51],[52], bien que des relations aient été proposées entre la présence d'archées méthanogènes et de maladies parodontales[53].
Bien qu’un grand nombre d’Archaea ne soient aujourd’hui pas cultivables en laboratoire, de nombreuses espèces peuvent être cultivées en utilisant des milieux de culture adaptés, et en reproduisant au mieux les conditions environnementales de leurs habitats naturels.
Comparaison entre archaea, bactéries et eucaryotes
Les Archaea sont similaires aux bactéries par beaucoup d’aspects de leur structure cellulaire et de leur métabolisme. Cependant, les mécanismes et les protéines impliqués dans les processus de réplication, de transcription et de traduction présentent des traits similaires à ceux rencontrés chez les eucaryotes. Les particularités des Archées par rapport aux deux autres domaines du vivant (Bactéries et Eucaryotes) sont les suivantes :
- la structure et la chimie des parois cellulaires, atypiques (absence de peptidoglycane classique chez les bactéries)
- la structure lipidique de leur membrane : les lipides des archéobactéries consistent en de longues chaînes d'alcool isopréniques attachées au glycérol par des liaisons éther - alors que les autres organismes fabriquent les lipides de leurs membranes en assemblant deux chaînes d'acides gras avec une molécule de glycérol par l'intermédiaire d'une liaison ester
- la présence d'ARN polymérases inhabituelles, beaucoup plus complexes que les ARN-polymérases des bactéries, et étonnamment proches de celles des eucaryotes.
- un chromosome circulaire de type bactérien mais comportant des gènes en mosaïque similaires à ceux des eucaryotes.
- les protéines intervenant dans les processus de réplication et de réparation de l'ADN ressemblent à celles rencontrées chez les eucaryotes[54].
- leur métabolisme (méthanogènes...)
Notes et références
- ↑ E.F. DeLong & N.R. Pace (2001). Environmental diversity of bacteria and archaea Syst. Biol. 50: 470-478.
- ↑ Woese C, Fox G (1977). Phylogenetic structure of the prokaryotic domain: the primary kingdoms. Proc Natl Acad Sci U S A 74 (11): 5088 – 5090. [1]
- ↑ Woese, Carl R., Kandler, Otto, Wheelis, Mark L (1990). Towards a natural system of organisms: Proposal for the domains Archaea, Bacteria, and Eucarya. Proceedings of the National Academy of Sciences 87 (12): 4576 – 4579.
- ↑ a , b et c DeLong EF, « Everything in moderation: archaea as 'non-extremophiles' », dans Curr. Opin. Genet. Dev., vol. 8, no 6, 1998, p. 649–54 [lien PMID lien DOI]
- ↑ Theron J, Cloete TE, « Molecular techniques for determining microbial diversity and community structure in natural environments », dans Crit. Rev. Microbiol., vol. 26, no 1, 2000, p. 37–57 [lien PMID lien DOI]
- ↑ Schmidt TM, « The maturing of microbial ecology », dans Int. Microbiol., vol. 9, no 3, 2006, p. 217–23 [[pdf] texte intégral lien PMID]
- ↑ Gevers D, Dawyndt P, Vandamme P, et al, « Stepping stones towards a new prokaryotic taxonomy », dans Philos. Trans. R. Soc. Lond., B, Biol. Sci., vol. 361, no 1475, 2006, p. 1911–6 [texte intégral lien PMID lien DOI]
- ↑ Robertson CE, Harris JK, Spear JR, Pace NR, « Phylogenetic diversity and ecology of environmental Archaea », dans Curr. Opin. Microbiol., vol. 8, no 6, 2005, p. 638–42 [lien PMID]
- ↑ Huber H, Hohn MJ, Rachel R, Fuchs T, Wimmer VC, Stetter KO., « A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont », dans Nature, vol. 417, no 6884, 2002, p. 27–8 [lien PMID lien DOI]
- ↑ Barns SM, Delwiche CF, Palmer JD, Pace NR, « Perspectives on archaeal diversity, thermophily and monophyly from environmental rRNA sequences », dans Proc. Natl. Acad. Sci. U.S.A., vol. 93, no 17, 1996, p. 9188–93 [texte intégral lien PMID lien DOI]
- ↑ Elkins JG, Podar M, Graham DE, et al, « A korarchaeal genome reveals insights into the evolution of the Archaea », dans Proc. Natl. Acad. Sci. U.S.A., vol. 105, no 23, June 2008, p. 8102–7 [texte intégral lien PMID lien DOI]
- ↑ Baker, B.J., Tyson, G.W., Webb, R.I., Flanagan, J., Hugenholtz, P. and Banfield, J.F., « Lineages of acidophilic Archaea revealed by community genomic analysis. Science », dans Science, vol. 314, no 6884, 2006, p. 1933 – 1935 [lien PMID lien DOI]
- ↑ Ciccarelli FD, Doerks T, von Mering C, Creevey CJ, Snel B, Bork P, « Toward automatic reconstruction of a highly resolved tree of life », dans Science, vol. 311, no 5765, 2006, p. 1283–7 [lien PMID lien DOI]
- ↑ Schopf J, « Fossil evidence of Archaean life », dans Philos Trans R Soc Lond B Biol Sci, vol. 361, no 1470, 2006, p. 869–85 [[pdf] texte intégral lien PMID lien DOI]
- ↑ Chappe B, Albrecht P, Michaelis W, « Polar Lipids of Archaebacteria in Sediments and Petroleums », dans Science, vol. 217, no 4554, July 1982, p. 65–66 [lien PMID lien DOI]
- ↑ Brocks JJ, Logan GA, Buick R, Summons RE, « Archean molecular fossils and the early rise of eukaryotes », dans Science, vol. 285, no 5430, 1999, p. 1033–6 [lien PMID lien DOI]
- ↑ Rasmussen B, Fletcher IR, Brocks JJ, Kilburn MR, « Reassessing the first appearance of eukaryotes and cyanobacteria », dans Nature, vol. 455, no 7216, October 2008, p. 1101–4 [lien PMID lien DOI]
- ↑ (en) Jürgen Hahn et Pat Haug, « Traces of Archaebacteria in ancient sediments », dans System Applied Microbiology, vol. 7, no Archaebacteria '85 Proceedings, 1986, p. 178–83.
- ↑ Woese CR, Gupta R, « Are archaebacteria merely derived 'prokaryotes'? », dans Nature, vol. 289, no 5793, 1981, p. 95–6 [lien PMID lien DOI]
- ↑ Woese C, « The universal ancestor », dans Proc. Natl. Acad. Sci. U.S.A., vol. 95, no 12, 1998, p. 6854–9 [texte intégral lien PMID lien DOI]
- ↑ Gupta RS, « The natural evolutionary relationships among prokaryotes », dans Crit. Rev. Microbiol., vol. 26, no 2, 2000, p. 111–31 [lien PMID lien DOI]
- ↑ Di Giulio, M. (2003) The universal ancestor was a thermophile or a hyperthermophile: tests and further evidence. J Theor Biol 221: 425-436.]
- ↑ Forterre, P., de la Tour, C.B., Philippe, H., and Duguet, M. (2000) Reverse gyrase from hyperthermophiles - probable transfer of a thermoadaptation trait from Archaea to Bacteria. Trends in Genetics 16: 152-154.
- ↑ Gribaldo S, Brochier-Armanet C, « The origin and evolution of Archaea: a state of the art », dans Philos. Trans. R. Soc. Lond., B, Biol. Sci., vol. 361, no 1470, 2006, p. 1007–22 [texte intégral lien PMID lien DOI]
- ↑ Woese CR, « There must be a prokaryote somewhere: microbiology's search for itself », dans Microbiol. Rev., vol. 58, no 1, March 1994, p. 1–9 [texte intégral lien PMID]
- ↑ Lake JA, « Origin of the eukaryotic nucleus determined by rate-invariant analysis of rRNA sequences », dans Nature, vol. 331, no 6152, January 1988, p. 184–6 [lien PMID lien DOI]
- ↑ Gouy M, Li WH, « Phylogenetic analysis based on rRNA sequences supports the archaebacterial rather than the eocyte tree », dans Nature, vol. 339, no 6220, May 1989, p. 145–7 [lien PMID lien DOI]
- ↑ Yutin N, Makarova KS, Mekhedov SL, Wolf YI, Koonin EV, « The deep archaeal roots of eukaryotes », dans Mol. Biol. Evol., vol. 25, May 2008, p. 1619 [texte intégral lien PMID lien DOI]
- ↑ Nelson KE, Clayton RA, Gill SR, et al, « Evidence for lateral gene transfer between Archaea and bacteria from genome sequence of Thermotoga maritima », dans Nature, vol. 399, no 6734, 1999, p. 323–9 [lien PMID lien DOI]
- ↑ Lake JA., « Origin of the eukaryotic nucleus determined by rate-invariant analysis of rRNA sequences », dans Nature, vol. 331, no 6152, 1988, p. 184–6 [lien PMID lien DOI]
- ↑ Galagan JE, et al, « The genome of M. acetivorans reveals extensive metabolic and physiological diversity », dans Genome Research, vol. 12, no 4, 2002-04, p. 532–42 (ISSN 1088-9051) [texte intégral lien DOI]
- ↑ Waters E, et al, « The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism », dans Proc. Natl. Acad. Sci. U.S.A., vol. 100, no 22, 2003, p. 12984–8 [texte intégral lien PMID lien DOI]
- ↑ Schleper C, Holz I, Janekovic D, Murphy J, Zillig W, « A multicopy plasmid of the extremely thermophilic archaeon Sulfolobus effects its transfer to recipients by mating », dans J. Bacteriol., vol. 177, no 15, 1995, p. 4417–26 [texte intégral lien PMID]
- ↑ (en) Sota M; Top EM, Plasmids: Current Research and Future Trends, Caister Academic Press, 2008, « Horizontal Gene Transfer Mediated by Plasmids »
- ↑ a et b Bernander R, « Archaea and the cell cycle », dans Mol. Microbiol., vol. 29, no 4, 1998, p. 955–61 [lien PMID lien DOI]
- ↑ Kelman LM, Kelman Z, « Multiple origins of replication in archaea », dans Trends Microbiol., vol. 12, no 9, 2004, p. 399–401 [lien PMID lien DOI]
- ↑ Kostrikina NA, Zvyagintseva IS, Duda VI., « Cytological peculiarities of some extremely halophilic soil archaeobacteria », dans Arch. Microbiol., vol. 156, no 5, 1991, p. 344–49 [lien DOI]
- ↑ DeLong EF, Pace NR, « Environmental diversity of bacteria and archaea », dans Syst. Biol., vol. 50, no 4, 2001, p. 470–8 [lien PMID lien DOI]
- ↑ a et b Pikuta EV, Hoover RB, Tang J, « Microbial extremophiles at the limits of life », dans Crit. Rev. Microbiol., vol. 33, no 3, 2007, p. 183–209 [lien PMID lien DOI]
- ↑ (en) Madigan MT, Martino JM, Brock Biology of Microorganisms, Pearson, 2006 (ISBN 0-13-196893-9), p. 136
- ↑ Takai K, Nakamura K, Toki T, Tsunogai U, Miyazaki M, Miyazaki J, Hirayama H, Nakagawa S, Nunoura T, Horikoshi K, « Cell proliferation at 122°C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation », dans Proc Natl Acad Sci U S A, vol. 105, 2008, p. 10949–54 [lien DOI]
- ↑ Ciaramella M, Napoli A, Rossi M, « Another extreme genome: how to live at pH 0 », dans Trends Microbiol., vol. 13, no 2, February 2005, p. 49–51 [lien PMID lien DOI]
- ↑ López-García P, López-López A, Moreira D, Rodríguez-Valera F, « Diversity of free-living prokaryotes from a deep-sea site at the Antarctic Polar Front », dans FEMS Microbiol. Ecol., vol. 36, no 2–3, July 2001, p. 193–202 [lien PMID]
- ↑ Karner MB, DeLong EF, Karl DM, « Archaeal dominance in the mesopelagic zone of the Pacific Ocean », dans Nature, vol. 409, no 6819, 2001, p. 507–10 [lien PMID lien DOI]
- ↑ Giovannoni SJ, Stingl U., « Molecular diversity and ecology of microbial plankton », dans Nature, vol. 427, no 7057, 2005, p. 343–8 [lien PMID lien DOI]
- ↑ DeLong EF, Karl DM, « Genomic perspectives in microbial oceanography », dans Nature, vol. 437, no 7057, September 2005, p. 336–42 [lien PMID lien DOI]
- ↑ Konneke M, Bernhard AE, de la Torre JR, Walker CB, Waterbury JB, Stahl DA., « Isolation of an autotrophic ammonia-oxidizing marine archaeon », dans Nature, vol. 437, no 7057, 2005, p. 543–6 [lien PMID lien DOI]
- ↑ Agogué H, Maaike B, Dinasquet J, Herndl GJ., « Major gradients in putatively nitrifying and non-nitrifying Archaea in the deep North Atlantic », dans Nature, vol. 456, no 7223, 2008, p. 788-791 [lien DOI]
- ↑ Teske A, Sørensen KB, « Uncultured archaea in deep marine subsurface sediments: have we caught them all? », dans ISME J, vol. 2, no 1, January 2008, p. 3–18 [lien PMID lien DOI]
- ↑ Lipp JS, Morono Y, Inagaki F, Hinrichs KU, « Significant contribution of Archaea to extant biomass in marine subsurface sediments », dans Nature, July 2008 [lien PMID lien DOI]
- ↑ Eckburg P, Lepp P, Relman D (2003). "Archaea and their potential role in human disease". Infect Immun 71 (2): 591-6.
- ↑ Cavicchioli R, Curmi P, Saunders N, Thomas T (2003). "Pathogenic archaea: do they exist?". Bioessays 25 (11): 1119-28.
- ↑ Lepp P, Brinig M, Ouverney C, Palm K, Armitage G, Relman D (2004). "Methanogenic Archaea and human periodontal disease". Proc Natl Acad Sci U S A 101 (16): 6176-81.
- ↑ Kelman, Z. (2000) DNA replication in the third domain (of life). Curr Protein Pept Sci 1: 139-154.
Articles connexes
- Bactéries carrées de Walsby
- Règnes du vivant
- Archaea (classification phylogénétique)
- Eubactéries
- Phylogénie
- Extrémophile
- Portail de la microbiologie
- Portail de l’origine et de l’évolution du vivant
Catégorie : Archaea - phylum Crenarchaeota
Wikimedia Foundation. 2010.
