- Oxysulfure de carbone
-
Oxysulfure de carbone 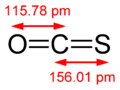

Général Nom IUPAC oxysulfure de carbone Synonymes carbone oxysulfure
sulfure de carbonyleNo CAS No EINECS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute COS [Isomères] Masse molaire[2] 60,075 ± 0,006 g·mol-1
C 19,99 %, O 26,63 %, S 53,38 %,Moment dipolaire 0,715189 D [1] Propriétés physiques T° fusion -138,81 °C[3] T° ébullition -50,2 °C[3] Solubilité 1,49 g·l-1 (eau,20 °C))[4] Masse volumique 1,178 g·cm-3 à -50,2 °C[3] T° d'auto-inflammation 250 °C[4] Limites d’explosivité dans l’air 6,5–29 %vol[3] Pression de vapeur saturante 11,28 bar à 20 °C[3] Point critique 63,5 bar, 105,65 °C [5] Thermochimie S0gaz, 1 bar 231,57 J·K-1·mol-1[6] S0liquide, 1 bar 136,31 J·K-1·mol-1[6] ΔfH0gaz -138,41 kJ·mol-1[6] ΔfusH° 4,728 kJ·mol-1 à -138,82 °C[6] ΔvapH° 18,506 kJ·mol-1 { -50,24 °C[6] Cp 41,48 J·K-1·mol-1 (gaz,24,85 °C)
71,25 J·K-1·mol-1 (liquide,-53,15 °C)[6]Propriétés électroniques 1re énergie d'ionisation 11,18 ± 0,01 eV (gaz)[8] Précautions Directive 67/548/EEC[3] 
T
F+Phrases R : 12, 23, Phrases S : 9, 16, 33, 36, 45, Transport[3] 263 2204 Écotoxicologie DL50 23 mg·kg-1 (rat, i.p.)[9] Unités du SI & CNTP, sauf indication contraire. L'oxysulfure de carbone (ou sulfure de carbonyle), de formule chimique COS, est un gaz incolore, toxique[10] et inflammable, principalement émis dans l'environnement par l'activité volcanique.
Il fait partie des ligands soufrés volatils (composés chimiques appartenant au cycle du soufre et interagissant chimiquement avec certains métaux).C'est un puissant gaz à effet de serre dont le rôle présent et passé dans les cycles biogéochimiques est encore mal compris.
Dans notre atmosphère riche en dioxygène ce gaz est rapidement dégradé (photolyse + probables phénomènes catalytiques). Il perd alors ses capacités de gaz réchauffant puisqu'au contraire, les composés issus de cette dégradation forment des aérosols soufrés qui renvoient vers l'espace une partie du rayonnement infrarouge solaire[11] (mais en contribuant secondairement à l'acidification des mers... laquelle, au delà d'un certain seuil pourrait rétroactivement diminuer la capacité des océans à stocker le CO2 sous forme de CaCO3, c'est-à-dire faire de l'océan une source de dioxyde de carbone, voire de méthane qui accélèrerait le réchauffement).Sommaire
Rôle dans les paléoclimats
Une équipe de chimistes danois (Université de Copenhague) et japonais (Institut de technologie de Tokyo) estime que ce gaz a joué durant l'archéen et avant cette période un rôle majeur, puisque :
- similaire au rôle joué aujourd'hui par l'ozone stratosphérique, c'est-à-dire protégeant la terre des UV solaires.
- comme gaz à effet de serre (stable à cette époque car l'atmosphère ne contenait pas d'oxygène), ayant permis que la Terre ne soit pas entièrement gelée avant l'archéen et au début de cette période (sans ce gaz, la température terrestre aurait été 30 % plus basse[12]' [13].) Grâce à lui toute l'eau n'a pas gelé sur Terre, ce qui a permis à la biodiversité naissante existante de mieux se maintenir alors que le Soleil était plus petit et émettait 30 % moins de chaleur que de nos jours.
Néanmoins les bactéries photosynthétiques ont à cette époque peu à peu libéré dans l'atmosphère une grande quantité d'oxygène, lequel a oxydé les composés carbonés et soufrés de l'air. Le soufre rejeté par les volcans au lieu d'être transformé en oxysulfure de carbone s'est alors peu à peu transformé en aérosols sulfatés qui ont considérablement refroidi la planète, conduisant à une Terre « boule de neige » (glaciation presque totale de la planète responsable d'une première grande extinction qui s'est étendue sur plusieurs millions d'années, marquant la fin de l'Archéen il y a environ 2,5 milliards d'années[14].
Propriétés physico-chimiques
C’est un gaz incolore et inflammable, à l’odeur désagréable d'œuf pourri (au delà d'un certain taux dans l'air, indétectable à faible concentration).
Sa molécule de structure linéaire est composée d'un groupe carbonyle lié par une double liaison à un atome de soufre.
Le sulfure de carbonyle peut être considéré comme un intermédiaire chimique entre le dioxyde de carbone et le disulfure de carbone, qui sont tous deux isoélectroniques de cette molécule.En présence d'humidité et de bases (métaux[15]), le sulfure de carbonyle se décompose en dioxyde de carbone et en sulfure d'hydrogène[16]' [17].
Rôle dans l'apparition de la vie
Ce composé catalyse la formation de peptides à partir d’acides aminés. Cette conclusion est une des suites de l'expérience de Miller-Urey qui laisse penser que le sulfure de carbonyle a pu jouer un rôle important dans l'apparition de la vie sur Terre[18].
Dans l’air
L’oxysulfure de carbone est le composé soufré le plus naturellement présent dans l'atmosphère, aujourd’hui présent à environ 0,5 (± 0,05) ppb car continuellement émis par les volcans, les marais et à partir des remontées d’eaux profondes, ce qui en fait un composé important dans le cycle global du soufre. Des analyses faites dans les carottes de glace de l’Antarctique donnent une image détaillée des fluctuations de teneurs en COS des années 1640 à nos jours, permettant notamment de séparer les origines anthropiques et naturelles. L’oxysulfure de carbone semble principalement transporté dans la stratosphère où il est oxydé par l'acide sulfurique.
La première source artificielle de ce gaz est industrielle (fuites de gaz utilisé comme intermédiaire en carbochimie ou perte comme sous-produit de la production de disulfure de carbone, mais d’autres sources importantes existent ;
- les automobiles,
- les centrales au charbon
- les centrales électriques
- la combustion de biomasse (incinération, crémation),
- la transformation du poisson,
- la combustion des ordures ménagères, de déchets contenant du carbone ou du soufre et des matières plastiques,
- la pétrochimie (dont raffineries)
- la fabrication de fibres synthétiques, d'amidon et de caoutchouc[16].
Le total des rejets directs d’oxysulfure de carbone dans l'atmosphère a été estimé à environ 3 millions de tonnes / an, dont un peu moins d’un tiers serait d’origine humaine[16]. C'est aussi une part importante des impuretés soufrées de différents syngas (gaz de synthèse) produit à partir de charbon ou pétrole.
Toxicologie, écotoxicologie
Jusqu’en 1994, la toxicité de ce produit ne semblait pas ou peu avoir fait l’objet d’études publiées. La toxicité aiguë chez l’Homme ou l’Animal était connue pour des concentrations élevées (> 1 000 ppm) pouvant provoquer l'effondrement soudain ou entrainer des convulsions et la mort par paralysie respiratoire[16],[17]. Des décès occasionnels avaient été rapportés, pratiquement sans irritation locale ni avertissement olfactif laissant penser qu’à des doses plus faible, la toxicité du produit pouvait aussi être importante[17]. 50 % des rats de laboratoires meurent après une exposition à 1 400 ppm de COS durant 90 minutes, ou à 3 000 ppm durant 9 minutes[17].
Des études sur le modèle animal (animaux de laboratoire) suggèrent également que l'inhalation continue de faibles doses (par exemple environ 50 ppm durant 12 semaines) n'affecte pas les poumons ou le cœur[17].- Il induit une irritation des voies respiratoires et peut dégrader le système nerveux central. Il est toxique par inhalation, avec risque de mort par paralysie respiratoire, suite aux effets sur le système nerveux central)
- CL50 : 1 700 ppm·h-1
- Toxique pour la vie aquatique.
- Dangereux pour l'eau potable.
Risques
- Risques d'incendie. L'exposition prolongée au feu des contenants peut induire l'explosion des récipients. La décomposition thermique produit des fumées toxiques et/ou corrosives suivantes en raison du monoxyde de carbone et dioxyde de soufre qu'elles contiennent.
- Mélange détonnant avec les oxydants forts.
- Risque d'inhalation (cf. toxicité ; voir § ci-dessus). Sous forme liquide, gazeuse ou vapeur, il est plus lourd que l'air , et peut s'accumuler dans les creux, caves, égouts ou dans le sol en cas d'accident.
- Risque de corrosion (par contact) des Aciers ferritiques (par ex. aciers au carbone) en présence de CO2 et d'humidité[19]. Le contact avec les élastomères suivants n'est pas recommandé : Isobutène - isoprène Buthyl (IIR) ; Nitrile (NBR) ; Chloroprène (CR) ; Ethylène - Propylène (EPDM)[19].
Dans les aliments
Du sulfure de carbonyle a été trouvé dans certains aliments (fromages) et dans les légumes préparés de la famille du chou (naturellement riche en soufre). Des traces de COS sont naturellement présentes dans certains grains ou graines (0,05 à 0,1 mg·kg-1).
Dans l'espace extra-atmosphérique
Du Sulfure de carbonyle a été découvert et observé dans le milieu interstellaire.
Utilisation
Le sulfure de carbonyle est utilisé comme intermédiaire dans la production d'herbicides (thiocarbamate) (EPA, 1994) et serait un biocide fumigant candidat potentiel pour remplacer le bromure de méthyle et la phosphine.
Production et synthèse
Il a pour la première fois été décrit en 1841[20] mais a apparemment été mal qualifié, confondu avec un mélange de dioxyde de carbone et de sulfure d'hydrogène.
Carl von Than a le premier (en 1867) caractérisé la substance, formée par réaction du monoxyde de carbone avec du soufre élémentaire. La synthèse en laboratoire implique la réaction de thiocyanate de potassium et d'acide sulfurique. Le gaz qui en résulte contient des quantités importantes de sous-produits et doit être purifié[21] :- KSCN + 2 H2SO4 + H2O → KHSO4 + NH4HSO4 + COS
Notes et références
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Carbonyl sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 septembre 2009 (JavaScript nécessaire)
- « Sulfure de carbonyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 16 septembre 2009
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) « Carbonyl sulfide » sur NIST/WebBook, consulté le 16 septembre 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8, ISBN 0-88415-858-6, ISBN 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- (en) « Carbonyl sulfide » sur ChemIDplus, consulté le 16 septembre 2009
- Fiche de sécurité d'Air Liquide (version 15/7/2005 consulté 2009/11/13)
- Crutzen, P. ; The possible importance of COS for the sulfate layer of the stratosphere ; journal = Geophys. Res. Lett., 1976 ; volume 3 ; pages = 73 à 76. DOI:10.1029/GL003i002p00073
- Des chercheurs ont découvert le gaz à effet de serre qui a sauvé la Terre 52009/09/11)
- Proceedings of the National Academy of Sciences (PNAS)
- Ueno Y., et al. (2009) Geological sulfur isotopes indicate elevated OCS in the Archean atmosphere, solving the faint young sun paradox. Proceedings of the National Academy of Sciences. DOI:10.1073/pnas.0903518106. (Résumé)
- Fiche INIS/CNRS « Etude de l'hydrolyse de l'oxysulfure de carbone et de l'hydrogénation du benzoate de méthyle sur oxydes métalliques; Application à la détermination de leurs propriétés superficielles »
- Hazardous Substances Data Bank (1994). MEDLARS Online Information Retrieval System, National Library of Medicine.
- Chemical Summary for Carbonyl sulfide, U.S. Environmental protection Agency. Il y a une coquille sur la ref qui dit "When exposed to humidity or alkalies ,decomposes to carbon monoxide and hydrogen sulfide." mais corrige en paragraphe III.C.3 : "hydrolyzed in water to hydrogen sulfide and carbon dioxide."
- Luke Leman, Leslie Orgel, M. Reza Ghadiri ; « Carbonyl Sulfide–Mediated Prebiotic Formation of Peptides » ; Science, 2004, volume 306 /5694, pages 283–286. DOI:10.1126/science.1102722. pmid : 15472077.
- Source : Air Liquide, consulté 2009 09 13
- Couërbe, J. P. ; Ueber den Schwefelkohlenstoff ; Journal für Praktische Chemie , 1841 ; volume = 23, pages 83 à 124. DOI:10.1002/prac.18410230105
- Ferm R. J. ; The Chemistry of Carbonyl sulfide ; journal Chemical Reviews, 1957, volume = 57, issue 4, pages 621 à 640. DOI:10.1021/cr50016a002
Voir aussi
Articles connexes
Liens et documents externes
- (en) National Pollutant Inventory: Carbon oxysulfide
- (en) Carbonyl sulfide and origins of life
- (en) Carbonyl sulfide in ice cores
- (en) Carbonyl sulfide as a potential fumigant
- (en) Carbonyl sulfide in the atmosphere
Bibliographie
- (fr) Profils (Graphique) de concentrations en hydrogène sulfure, oxysulfure de carbone et méthane thiol dans une lentille de dilution de l'eau du Rhône dans la méditerranée, en aval de l'estuaire (Laboratoire de biogéochimie des contaminants métalliques de Nantes)] (En savoir plus sur le suivi des eaux du Rhône en Méditerranée occidentale (campagnes BiopRhofi et RhofiH), 2006)
- (en) Fiche Inist/Cnrs ; Les sources et les puits d'oxysulfure de carbone (COS) à l'échelle mondiale
- Beck, M. T.; Kauffman, G. B., « COS and C3S2: The Discovery and Chemistry of Two Important Inorganic Sulfur Compounds », dans Polyhedron, vol. 4, no 5, 1985, p. 775–781 [lien DOI]
- Svoronos P. D. N., Bruno T. J., « Carbonyl sulfide: A review of its chemistry and properties », dans Industrial & Engineering Chemistry Research, vol. 41, no 22, 2002, p. 5321–5336 [lien DOI]
Catégories :- Produit chimique toxique
- Produit chimique extrêmement inflammable
- Sulfure
- Composé inorganique du carbone
- Gaz à effet de serre
- Polluant
Wikimedia Foundation. 2010.





