- Phosphore jaune
-
Phosphore blanc
Phosphore blanc 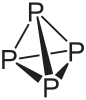
Général No CAS No EINECS PubChem SMILES InChI Apparence solide cristallin transparent blanca jaune d'apparence cireuse.devient sombre lors d'exposition a la lumiere.[1] Propriétés chimiques Formule brute P4 [Isomères] Masse molaire 123,895048 g∙mol-1
P 100 %,Propriétés physiques T° fusion Se décompose au-dessous du point de fusion à 44 °C[1] T° ébullition 282 °C Solubilité dans l'eau à 20 °C : 0.0003 g/100 ml[1] Masse volumique 1.83 g/cm³[1] T° d’auto-inflammation 30 °C[1] Point d’éclair 30 °C Pression de vapeur saturante 0,033 mbar à 20 °C,
0,076 mbar à 30 °C,
0,32 mbar à 50 °CPrécautions Directive 67/548/EEC 
T+
C
F
NPhrases R : 17, 26/28, 35, 50, Phrases S : 1/2, 5, 26, 38, 45, 61, [2] Transport 46 1381
446 2447 [3]SGH[4] 



DangerUnités du SI & CNTP, sauf indication contraire. Le phosphore blanc (aussi appelé phosphore jaune) est un allotrope commun de l'élément chimique phosphore qui permet des utilisations militaires extensives comme agent incendiaire, agent de protection par écran de fumée, et comme un composant d'arme anti-personnel capable de provoquer des brûlures graves. Couramment utilisé en tant que fumigène, il devient une arme chimique lorsqu'il est utilisé directement pour ses capacités offensives. Le protocole III additionnel à la Convention sur certaines armes classiques de l'ONU, signé en 1983, interdit son utilisation offensive, qui est considérée comme un crime de guerre.
Sommaire
Propriétés chimiques
Utilisations en tant qu'arme chimique
 Explosion d'une bombe au phosphore en 1918 (Gondrecourt, France)
Explosion d'une bombe au phosphore en 1918 (Gondrecourt, France)
Le phosphore blanc semble avoir été utilisé pour la première fois durant le XIXe siècle par des nationalistes irlandais sous la forme d'une solution de phosphore dilué dans du sulfure de carbone. Lorsque ce dernier s'évaporait, le phosphore blanc s'enflammait puis chauffait à son tour les fumées hautement inflammables du sulfure de carbone. Cette mixture nommée « feu fénien » fut par ailleurs employée en Australie par des travailleurs temporaires mécontents. En 1916, lors des débats animés sur l'entrée en guerre de l'Australie, la police de Sydney avertit quatre hommes d'affaires des risques qu'ils couraient : ceux-ci étaient la cible de l'Industrial Workers of the World, un groupe de travailleurs qui étaient ouvertement opposés à la guerre. Douze membres de cette union furent arrêtés et accusés de la détention de produits incendiaires dont du phosphore et de la préparation d'une attaque avec ces matières. Selon Ian Turner [5], neuf des accusés furent en fait victimes d'un complot organisé par la police. La plupart des accusés (surnommés les Sydney Twelve) furent condamnés à 15 ans de réclusion mais finalement dix d'entre eux furent relâchés en 1920. Les deux autres furent libérés un peu plus tard.
Première et Seconde Guerres mondiales
L'armée britannique introduit ses premières grenades à phosphore, fabriquées de manière industrielle, vers la fin 1916. Durant la Seconde Guerre mondiale, le phosphore blanc fut utilisé de manière intensive par les Américains et les forces du Commonwealth dans l'ensemble des projectiles possibles : mortiers, obus, roquettes, grenades, bombes incendiaires, etc. Les Japonais employèrent aussi cette substance mais dans des proportions moindres, essentiellement pour générer de la fumée et pour des armes anti-personnel. En 1940, alors que l'invasion de la Grande-Bretagne paraissait imminente, la fabrique de phosphore Albright and Wilson suggéra au gouvernement britannique d'utiliser une mixture similaire au feu fénien dans des armes incendiaires. De cette idée naquit la No. 76 Special Incendiary Grenade [6] (aussi nommée Special Incendiary Phosphorus grenade), une grenade qui ressemblait plus à un cocktail molotov qu'aux classiques grenades à main. Elle était composée d'une bouteille de verre remplie d'un liquide similaire au feu fénien, avec un peu de latex. Deux versions furent fabriquées : la première avec un capuchon rouge et destinée au lancé à la main, la deuxième qui était plus solide, avec un capuchon vert et qui devait être propulsée à partir d'un lance-grenades Northover [7]. Les instructions les concernant étaient strictes et elles étaient considérées comme extrêmement dangereuses pour leurs propres opérateurs :
- les bombes devaient être stockées dans des endroits froids, si possible sous l'eau et dans des caisses
- des précautions particulières devaient être prises pour éviter qu'elles ne se cassent ou fendent lors de leur manipulation
Il arrivait parfois que la grenade explose lors du tir.
Au début de la campagne de Normandie, 20% des obus de mortier de 81mm étaient aux phosphores (modèle WP 57 [8]). Au moins cinq Medal of Honor furent décernées avec la mention de l'utilisation de grenades au phosphore pour nettoyer les positions ennemies. Durant la bataille de Normandie, le 87e bataillon de mortiers américains tira à lui seul 11 899 obus au phosphore sur la ville de Cherbourg [9]. Des obus de 10,7 cm remplis de phosphore furent aussi utilisés par les Américains. Les qualités militaires du phosphore furent souvent mentionnées par les soldats alliés en raison de son rôle défensif primordial lors des attaques par l'infanterie allemande et pour déclencher la confusion dans les concentrations ennemies vers la fin de la guerre.
Les bombes incendiaires employèrent initialement du magnésium pour enflammer leur mélange. Le magnésium fut plus tard dans la guerre remplacé dans certaines bombes par du phosphore. Ces bombes furent utilisées lors de bombardements stratégiques de villes en Allemagne et au Japon.
Autres conflits
 Inspection d'une roquette au phosphore dans une base américaine en Corée du Sud, 1996
Inspection d'une roquette au phosphore dans une base américaine en Corée du Sud, 1996
Durant la guerre du Viêt-Nam, les soldats américains surnommèrent les bouteilles de phosphore des Willie Pete [10],[11] (utilisant les mêmes initiales que White Phosphorus, phosphore blanc en anglais).
L'emploi lors d'attaques terroristes est par ailleurs attesté (ex. Vol 111 de Pan Am en 1973 [12]).
L'Irak aurait employé des obus et des roquettes au phosphore blanc en 1991 pour mater la rébellion kurde [13]. La Papouasie-Nouvelle-Guinée l'aurait employée contre les indépendantistes de l’île de Bougainville (extrême est de la Papouasie-Nouvelle-Guinée), selon l’Armée révolutionnaire de Bougainville (ARB) [14].
La Russie a utilisé des fumigènes au phosphore blanc en Tchétchénie au milieu des années 1990. La proportion d'obus fumigènes ou à phosphore durant la bataille de Grozny est comprise entre 20 et 25 % [15]. Le Pentagone s'en est servi lors de la bataille de Falloujah, en novembre 2004, en Irak [16].
Le phosphore blanc a également été utilisé comme fumigène ou éclairant par Tsahal, l'armée israélienne, lors du siège de Beyrouth en 1982 et aussi pendant l'offensive sur le Liban de 2006 [17],[18],[19]. Enfin, Tsahal a aussi utilisé de telles armes dans la bande de Gaza à l'automne 2006[20]
Israël a utilisé pendant la Guerre de Gaza 2008-2009, en 2009, des obus fumigènes éclairants au phosphore blanc sur les zones urbaines de la bande de Gaza. L'armée israélienne assure que l'utilisation de ses armes « s'exerce dans le cadre des frontières légales du droit international ». L'Organisation humanitaire Human Rights Watch considère cependant que le droit international coutumier interdit l'utilisation des armes au phosphore blanc dans un endroit aussi densément peuplé que la bande de Gaza[21],[22],[23]. Selon l'expert Joseph Henrotin,
« On a affaire à un paradoxe. Les Israéliens veulent combattre de nuit pour permettre de surprendre les combattants du Hamas et de les avoir aussi à la fatigue. Le problème, dans le cas de Gaza, est qu’il faut éclairer des petites rues. Les Israéliens vont effectuer des largages de leurs munitions à basse altitude avec pour but d’éclairer et de faciliter la désignation de cibles. Il s’agit de viser mieux pour éviter les civils. Le grand paradoxe est que, dans ce cas-là, vous vous retrouvez avec des débris d’armes et de phosphore en combustion qui effectivement atteignent des civils et/ou des combattants. Cela cause des brûlures assez graves. Mais c’est un dommage collatéral qui résulte assez paradoxalement de la nécessité de disposer de plus d’éclairage pour éviter les bavures[24]. »Le 17 janvier 2009, Peter Herby, chef de l’Unité armes au Comité international de la Croix-Rouge, a confirmé l’utilisation d’armes au phosphore blanc par Israël à Gaza. Dans un interview il a donné un aperçu des règles applicables aux armes au phosphore et expliqué la position du CICR sur cette question. [25]
Ni les États-Unis ni Israël ainsi que l'ensemble des pays du monde arabo-musulman ne sont signataires du Protocole additionnel de 1983[26], ils ne peuvent donc pas être poursuivis pour l'utilisation offensive de phosphore blanc.
Accidents
Le phosphore blanc est à l'origine d'un accident en Ukraine, en juillet 2007.
Propriétés en tant que fumigène
 Test de bombardement sur le navire de guerre USS Alabama en 1921. On remarque la forme caractéristique d'une explosion au phosphore avec son faisceau de traits blancs
Test de bombardement sur le navire de guerre USS Alabama en 1921. On remarque la forme caractéristique d'une explosion au phosphore avec son faisceau de traits blancs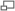
Le phosphore est l'agent le plus efficace connu à ce jour pour produire de la fumée. Il s'agit en fait d'un aérosol dont la taille des gouttes s'approche de la valeur idéale pour avoir une fumée blanche selon la théorie de Mie. De plus, il s'avère efficace contre les systèmes d'imagerie thermique même si la durée de cette protection est courte. Lorsque les particules ont fini de se consumer, la fumée passe d'un mode émission à un mode absorption. Si l'aérosol refroidi offre toujours une protection idéale pour le spectre visible, il perd ses qualités avec les infrarouges avec une absorption et une diffusion faible. Il existe des additifs qui permettent d'améliorer ces caractéristiques [27],[28],[29].
Quand le phosphore se consume dans l'air, il forme du pentoxyde de phosphore :
- P4 + 5 O2 → P4O10
Le pentoxyde de phosphore étant extrêmement hygroscopique, il absorbe la moindre trace d'humidité pour former des gouttelettes d'acide phosphorique :
- P4O10 + 6 h2O → 4 H3PO4 (qui produit aussi des polyphosphates comme l'acide pyrophosphorique, H4P2O7)
Comme l'atome de phosphore a une masse atomique de 31 mais qu'une molécule d'acide phosphorique a une masse moléculaire de 98, le nuage reçoit déjà 68% de sa masse à partir de l'atmosphère (ie. on obtient 3,2 kg d'aérosol pour chaque kilogramme de phosphore blanc). Cependant, il peut augmenter cette masse puisque l'acide phosphorique et ses dérivés sont aussi hygroscopiques. Avec le temps, les gouttes absorbent de plus en plus d'eau et s'élargissent jusqu'à atteindre un équilibre qui dépend de la pression locale. En pratique, les gouttelettes atteignent rapidement un rayon idéal pour la diffusion de la lumière visible. Elles sont ensuite soumises aux conditions météorologiques, en particulier le vent et la convection causée par la chaleur des réactions.
En raison de son rapport poids/efficacité optimal, le phosphore blanc est particulièrement adapté aux applications où le poids est un critère important, comme les grenades et les obus de mortier. Sa rapidité de réaction s'avère intéressante pour les situations d'urgence où une grenade devrait être lancée pour se camoufler. Le phosphore blanc de part sa nature pyrophorique (il s'enflamme à l'air libre) n'a pas besoin d'un mécanisme compliqué pour être actif : la plupart des munitions se contentent de projeter le phosphore après l'ouverture de leur enveloppe. Les particules s'enflamment spontanément, ce qui donne lieu à l'apparition d'un nuage caractéristique avec des traits blancs partant du centre (indiquant la trajectoire des morceaux de phosphore) et un écran dense d'un blanc intense.
En contrepartie, la toxicité du phosphore blanc le rend inutilisable dans certains cas. Par ailleurs, les réactions chimiques engendrent un aérosol et des gaz dont la température est très élevée. Les gaz chauds montent rapidement dans l'atmosphère et attirent le nuage, produisant un effet "pilier" indésirable dans certaines situations. Des additifs permettent ici aussi d'éviter ce type de problème et garantissent un nuage suffisamment dense et concentré. Certains pays ont remplacé le phosphore blanc par le phosphore rouge. Ce dernier brûle à une température moins élevée et s'avère moins toxique. Il existe encore d'autres alternatives comme le phosphore blanc plasticisé [30],[31].
Notes et références
- ↑ a , b , c , d et e PHOSPHORE BLANC, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « phosphore » sur ESIS, consulté le 11 février 2009
- ↑ Entrée du numéro CAS « 12185-10-3 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Ian Turner, Sydney's Burning - The real conspiracy, Alpha Books, Sydney, 1969, [1]
- ↑ No. 76 Grenade
- ↑ Northover Projector
- ↑ Obus mortier 81mm
- ↑ The Chemical Warfare Service: Chemicals in Combat, de Brooks E. Kleber, Dale Birdsell - version en cache dans Google
- ↑ BBC NEWS | Americas | White phosphorus: weapon on the edge
- ↑ Infoshop News - White Phosphorus, a California Embed, and 'The Times'
- ↑ Death in Rome Aboard Flight 110 -- Printout -- TIME
- ↑ US intelligence classified white phosphorus as 'chemical weapon' - Independent Online Edition > Americas
- ↑ "La Papouasie-Nouvelle Guinée utilise du phosphore blanc" in L'Humanité du 17 août 1996
- ↑ White Phosphorus (WP)
- ↑ Cf. Falloujah, le massacre caché, documentaire de la RAI italienne diffusé en novembre 2005, et Le Pentagone avoue avoir utilisé des armes chimiques à Fallouja, dans L'Humanité, 22 novembre 2005
- ↑ Amnesty International, Israel/Lebanon — Israel and Hizbullah Must Spare Civilians; Obligations under international humanitarian law of the parties to the conflict in Israel and Lebanon (en particulier section 8.4) AI Index: MDE 15/070/2006 ; 26 July 2006
- ↑ « Liban : le PNUE (Programme des Nations Unies pour l'Environnement) conclut à l'utilisation de phosphore par Israël, mais pas d'uranium appauvri », Centre de nouvelles ONU, 16 novembre 2006, accessible ici
- ↑ « Israël reconnaît avoir utilisé des obus au phosphore contre le Hezbollah au Liban », Le Monde, 25 octobre 2006
- ↑ Les armes expérimentales de Tsahal en accusation », in Le Figaro, 16 novembre 2006
- ↑ (en)Gaza Israël attacks artillery sur le Guardian
- ↑ (fr)Selon le "Times", Israël utilise des bombes au phosphore pour couvrir l'assaut de ses soldats sur Le Monde
- ↑ (fr)Bombes au phosphore: à Gaza, Israël surfe sur le droit swissinfo.ch
- ↑ (fr) Gérald Papy, « Guerre de Gaza : Arme "légal", usage critiqué » sur lalibre.be, 14 janvier 2009, La Libre Belgique. Consulté le 22 janvier 2009
- ↑ Les armes au phosphore – point de vue du CICR
- ↑ Pays signataires
- ↑ Infrared smoke (Arno Hahma)
- ↑ Studies of IR-Screening Smoke Clouds, Stanislaw Cudzio
- ↑ Smokes and Obscurants: A Health and Environmental Effects Data Assessment
- ↑ UN - List of Explosive Materials
- ↑ T148, GRENADES
Voir aussi
- Portail de la chimie
- Portail de l’histoire militaire
Catégories : Composé du phosphore | Produit chimique très toxique | Produit chimique corrosif | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Arme incendiaire | Arme chimique | Équipement militaire | Bombardement | Pnictogène
Wikimedia Foundation. 2010.