- Polio
-
Poliomyélite
Poliomyélite
(Maladie de Heine-Medin)
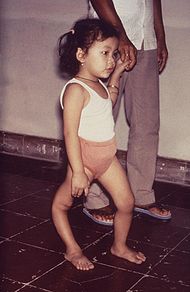
Classification et ressources externesEnfant présentant une amyotrophie du membre inférieur droit due à la poliomyélite CIM-10 A80, B91 CIM-9 045, 138 La poliomyélite (du grec polios (πολίός) « gris », -myelos (µυελός) « moelle » et -ite « inflammation »),[1] également appelée maladie de Heine-Medin, paralysie spinale infantile ou simplement polio, est une maladie infectieuse aiguë et contagieuse spécifiquement humaine causée par trois virus à ARN du genre Entérovirus, les poliovirus.
L'infection à poliovirus, transmise par voie digestive (oro-fécale), est inapparente chez 90 à 95 % des sujets et se traduit dans le reste des cas par des symptômes le plus souvent bénins et non spécifiques (pharyngite, syndrome grippal, vomissements).[2]'[3] L'infection du système nerveux central, la plus sérieuse, complique environ un cas sur cent. Elle entraîne une méningite et s'accompagne, dans la moitié des cas, d'une lésion des motoneurones de la corne antérieure de la moelle épinière qui définit la poliomyélite proprement dite ou poliomyélite antérieure aiguë. Il en résulte une paralysie flasque asymétrique intéressant le plus souvent les membres inférieurs.
La poliomyélite a été décrite et étudiée au XIXe siècle par Heine et Medin [4]. Des années 1880 jusqu'à la seconde moitié du XXe siècle, la maladie a sévi dans le monde entier sur un mode épidémique et handicapé ou tué plusieurs millions de personnes. Les progrès de l'hygiène et surtout la vaccination, découverte par Salk et Sabin, ont permis un recul considérable de son incidence. Depuis 1988, l'éradication de la poliomyélite fait l'objet d'une initiative mondiale sous l'égide de l'OMS, de l'Unicef et du Rotary International.[5] La campagne de vaccination de masse a fait passer son incidence de 350 000 nouveaux cas par an en 1988 à environ 1 500 en 2008 [6] et son éradication est officielle sur tout le continent américain, en Europe et dans les régions OMS du Pacifique occidental, Chine comprise.[7] En 2008, la maladie restait endémique dans seulement quatre pays (Nigeria, Inde, Pakistan et Afghanistan) qui concentraient à eux seuls la quasi totalité des cas.[8]
Sommaire
Agent causal
La poliomyélite est causée par les poliovirus, virus à ARN du genre Entérovirus et de la famille des Picornaviridae. L'Homme est le seul réservoir du virus.[7] Les poliovirus ont un tropisme préférentiel pour le tractus digestif.[2] Leur structure est très simple, composée d'un génome ribonucléique de sens positif entouré d'une capside.[3] La capside protège le matériel génétique et rend possible l'infection de certains types de cellules par le virus. Trois sérotypes de poliovirus ont été identifiés : poliovirus type 1 (PV1), type 2 (PV2) et type 3 (PV3), chacun différant légèrement des autres par les protéines de sa capside.[9] Tous trois sont extrêmement virulents et produisent les mêmes symptômes.[3] PV1 est la forme la plus régulièrement rencontrée, et la plus fréquemment associée à la paralysie.[10]
Physiopathologie
Transmission
La poliomyélite est très contagieuse et se transmet facilement par contact interhumain.[11] En zone d'épidémie, les souches sauvages de poliovirus sont théoriquement capables d'infecter la totalité de la population humaine.[12] La transmission est habituellement saisonnière sous les climats tempérés, avec un pic en été et en automne.[11] Ces différences saisonnières sont beaucoup moins prononcées sous les climats tropicaux.[12] La période d'incubation, qui sépare la première exposition des premiers symptômes, est habituellement comprise entre six et vingt jours, avec des valeurs extrêmes allant de trois à trente-cinq jours.[13] Des particules virales sont excrétées dans les fèces durant plusieurs semaines après l'infection initiale.[13] La transmission de la maladie est ainsi essentiellement digestive par voie oro-fécale, via l'ingestion d'aliments ou d'eau contaminés. Occasionnellement, la maladie peut être transmise par voie oro-orale via la salive,[10] voie qui semble prépondérante dans les zones à haut niveau d'hygiène.[11] La contagiosité est maximale entre les sept à dix jours qui précèdent et les sept à dix jours qui suivent l'apparition des symptômes, mais la transmission est possible tant que le virus persiste dans la salive et les matières fécales.[10]
Parmi les facteurs qui augmentent le risque d'infection ou influencent péjorativement la sévérité de la maladie, l'immunodépression,[14] la malnutrition,[15] l'amygdalectomie,[16] l'activité physique suivant immédiatement la survenue de la paralysie,[17] l'injection intramusculaire de vaccins ou de médicaments [18] et la grossesse [19] ont été cités. Bien que le virus franchisse le placenta durant la grossesse, le fœtus semble n'être atteint ni en cas d'infection maternelle ni en cas de vaccination.[20] Les anticorps maternels franchissent également la barrière placentaire, apportant au fœtus une immunité passive protectrice durant la grossesse et les premiers mois de la vie.[21]
Infection
Le poliovirus pénètre dans l'organisme par la bouche et infecte les premières cellules avec lesquelles il rentre en contact dans le pharynx puis dans la muqueuse intestinale. Il infecte les cellules par l'intermédiaire d'une glycoprotéine transmembranaire de la famille des immunoglobulines située à la surface de la cellule, le récepteur CD155 ou récepteur du poliovirus[22]. Le virus prend alors le contrôle des processus génétiques de la cellule hôte et débute sa réplication. Le poliovirus se multiplie au sein des cellules gastro-intestinales durant une semaine environ, puis migre vers les amygdales (spécifiquement les cellules dendritiques folliculaires des centres germinaux amygdaliens), le tissu lymphoïde intestinal (dont les cellules M des plaques de Peyer) et les ganglions lymphatiques cervicaux et mésentériques, où il se multiplie activement. Le virus peut alors passer dans la circulation[23].
La phase de circulation sanguine du virus, ou virémie, permet sa distribution à différents sites de l'organisme. Le poliovirus peut survivre et se multiplier dans le sang et dans la lymphe pendant des périodes prolongées allant parfois jusqu'à 17 semaines[24]. La virémie est responsable du syndrome grippal généralement observé dans la première phase des infections à poliovirus symptomatiques. Dans une faible proportion de cas, le virus peut migrer et se répliquer dans le tissu adipeux, le système réticuloendothélial et les muscles[25]. Le passage du virus dans le système nerveux central est responsable d'une réponse inflammatoire locale. Dans la plupart des cas celle-ci est limitée aux méninges et définit une méningite aseptique non paralytique[1]. L'infection du parenchyme cérébral définit une encéphalite aiguë. Le mécanisme par lequel le poliovirus infecte le système nerveux central n'est pas entièrement élucidé, mais il semble indépendant de l'âge, du sexe et du niveau socioéconomique du sujet[26].
Immunisation
Le contact avec le virus (par infection ou par vaccination) est immunisant. Chez les sujets immunisés, des anticorps de type IgA sont sécrétés au niveau des amygdales et de la muqueuse digestive qui sont capables de bloquer la réplication virale. Les IgG et IgM sont protecteurs vis-à-vis de l'atteinte du motoneurone.[11] L'infection ou la vaccination par un sérotype de poliovirus n'immunise pas contre les deux autres, l'immunité complète requiert donc l'exposition à chaque sérotype.[11]
Formes cliniques
Traduction clinique de l'infection Traduction Proportion de cas[27] Asymptomatique 90–95% Symptômes mineurs 4–8% Méningite aseptique
non-paralytique1–2% Poliomyélite paralytique 0.1–0.5% — Polio spinale 79% des cas paralytiques — Polio bulbospinale 19% des cas paralytiques — Polio bulbaire 2% des cas paralytiques Chez la plupart des sujets immunocompétents l'infection à poliovirus reste asymptomatique, les anticorps neutralisants sécrétés au niveau digestif assurant un rôle protecteur vis-à-vis du virus. Le terme poliomyélite se réfère à une infection symptomatique causée indistinctement par les trois sérotypes de poliovirus. Deux formes principales d'infection symptomatique sont décrites : une forme extra-neurologique parfois qualifiée de « poliomyélite abortive » (97 % des cas) d'évolution le plus souvent favorable, et une forme neurologique avec atteinte du système nerveux central (3 % des cas environ) qui peut être paralytique ou non paralytique.[28]
Formes extra-neurologiques
Si le virus franchit la barrière digestive, l'infection se traduit par des manifestations générales mineures et non spécifiques allant de l'infection des voies respiratoires (maux de gorge, toux, fièvre) aux signes digestifs (nausées, vomissements, douleurs abdominales, constipation ou, rarement, diarrhée) en passant par le syndrome grippal.[27] Myocardite et péricardite sont possibles et parfois associées.[7]
Formes neuroméningées non paralytiques
Le virus atteint le système nerveux central dans environ 3 % des cas, parmi lesquels une majorité développe un syndrome méningé fébrile (céphalées, douleurs cervicales et dorsales, fièvre, nausées, vomissements, léthargie) traduisant une méningite à liquide céphalo-rachidien clair, d'évolution favorable. L'absence de paralysie est alors la règle.[1][29] Les formes encéphalitiques sont rares et surviennent presque exclusivement chez les nourrissons, s'accompagnant d'une fièvre élevée, de modifications du comportement, de crises convulsives généralisées et de paralysie spastique.[30] Une paralysie faciale périphérique isolée est possible.[7]
Poliomyélite antérieure aiguë
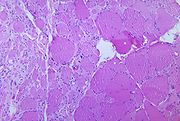 La dénervation du tissu musculaire squelettique secondaire à l'infection par le poliovirus peut conduire à la paralysie.
La dénervation du tissu musculaire squelettique secondaire à l'infection par le poliovirus peut conduire à la paralysie.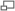
Entre 1 sujet sur 200 et 1 sujet sur 1 000 évolue vers une maladie paralytique qui se traduit par la survenue d'une faiblesse musculaire croissante jusqu'à la paralysie complète. Après incubation, la maladie se traduit par un syndrome infectieux fébrile non spécifique (pharyngite, troubles digestifs) suivi de l'installation rapide, en quelques heures, de paralysies flasques sans atteinte sensitive. L'atteinte est toujours asymétrique[7].
Le poliovirus migre le long des trajets nerveux et atteint les motoneurones de la corne antérieure de la moelle épinière, du tronc cérébral ou du cortex moteur dans lesquels il se réplique et qu'il détruit. La paralysie qui en résulte définit la poliomyélite paralysante, dont les diverses variantes (spinale, bulbaire, spinobulbaire) diffèrent par l'étendue des dommages causés aux motoneurones, par l'inflammation subséquente et par les régions du système nerveux central qui sont touchées. Les lésions s'étendent au ganglion spinal, parfois à la formation réticulée, aux noyaux vestibulaires, au vermis cérébelleux et aux noyaux gris centraux[26]. L'inflammation associée à la destruction neuronale altère souvent la couleur et l'apparence de la substance grise de la moelle épinière, qui apparaît rougeâtre et tuméfiée[1]. Des lésions du prosencéphale sont également associées à la poliomyélite paralytique, touchant particulièrement le thalamus et l'hypothalamus[26]. Les mécanismes moléculaires qui conduisent à la paralysie restent mal compris.
La propension à développer une poliomyélite paralytique augmente avec l'âge, de même que le risque de paralysie étendue. Chez les enfants, la méningite non paralytique est la conséquence la plus fréquente de l'infection du système nerveux central. La paralysie ne survient que dans 1 cas sur 1 000 et, avant l'âge de cinq ans, ne concerne généralement qu'un membre inférieur. Chez l'adulte, la paralysie survient dans 1 cas sur 75[31]. Elle s'étend plus volontiers aux muscles du thorax et de l'abdomen, voire aux quatre membres (quadriplégie)[32]. Le taux de paralysie varie également selon le sérotype viral. Ainsi le poliovirus 1 en est-il le premier pourvoyeur (1 cas sur 200) devant le PV3 et le PV2 (1 cas sur 2 000)[33].
Symptomatologie précoce
La poliomyélite antérieure aiguë se traduit par une symptomatologie précoce qui associe fièvre élevée, céphalées, raideur cervicale et dorsale, myalgies, faiblesse asymétrique de plusieurs muscles, sensibilité au toucher, troubles de la déglutition, disparition des réflexes ostéo-tendineux, paresthésies, irritabilité, constipation, difficultés mictionnelles. La paralysie survient en général un à dix jours après le début des symptômes, progresse durant deux ou trois jours, et cesse de s'étendre au moment de la défervescence[34].
Poliomyélite spinale
Localisation des motoneurones (en rouge) dans la corne antérieure du cordon médullaire (ici en région cervicale).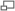
La poliomyélite spinale est la forme la plus courante de poliomyélite paralytique. Elle résulte de l'invasion par le poliovirus des motoneurones de la corne antérieure de la moelle épinière (partie ventrale de la substance grise), qui véhiculent l'ordre transmis par le cortex moteur et sont responsables des mouvements. Les nerfs moteurs spinaux innervent les muscles du tronc (dont les muscles intercostaux et le diaphragme) et des membres[35].
L'infection virale cause une inflammation des cellules nerveuses, conduisant à la destruction partielle ou totale du ganglion des motoneurones. La mort des motoneurones entraîne leur dégénérescence wallérienne[36]. Les cellules musculaires ne recevant plus de signaux en provenance du cortex moteur ni de la moelle épinière s'atrophient, s'affaiblissent et deviennent rapidement inactives[35]. La destruction partielle totale de l'innervation d'un muscle détermine l'intensité de sa paralysie. L'évolution vers une paralysie maximale est rapide (deux à quatre jours) et s'associe généralement à une fièvre et des myalgies[36]. L'arc du réflexe myotatique étant interrompu, les réflexes ostéo-tendineux sont abolis. En revanche, l'intégrité des nerfs sensitifs permet la préservation de la somesthésie[36].
La distribution de la paralysie spinale dépend de l'étage médullaire atteint, qui peut être cervical, thoracique, lombaire ou combiné[37]. L'atteinte peut être bilatérale, mais elle est toujours asymétrique[7]. La paralysie est souvent plus marquée pour les muscles proximaux (proches de la racine des membres) que pour les muscles distaux (doigts et orteils)[23].
Poliomyélite bulbaire
 Anatomie du bulbe rachidien (en orange)
Anatomie du bulbe rachidien (en orange)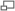
La poliomyélite bulbaire représente 2 % des cas de poliomyélite paralytique. Elle est la conséquence de l'invasion et de la destruction par le poliovirus des motoneurones de la région bulbaire du tronc cérébral[27] qui entraîne la paralysie des muscles innervés par les nerfs crâniens, des signes d'encéphalite, des difficultés respiratoires, des troubles de la phonation et de la déglutition[29]. Les trois nerfs crâniens les plus critiques sont le nerf glossopharyngien (IXe paire), qui contrôle les mouvements de l'oropharynx et la déglutition, le nerf vague (Xe paire) qui joue notamment un rôle majeur dans la phonation et le nerf accessoire (XIe paire) qui innerve le sterno-cléido-mastoïdien et le trapèze. L'atteinte du nerf trijumeau (Ve paire) et du nerf facial (VIIe paire) expose au risque de paralysie faciale et de troubles de la mastication. L'atteinte des nerfs oculomoteurs (IIIe et VIe paires) entraîne une diplopie.
Poliomyélite spinobulbaire
Forme combinée des deux précédentes, la poliomyélite spinobulbaire représente 19 % des cas de poliomyélite paralytique. Elle est parfois qualifiée de poliomyélite respiratoire[27]. Le virus s'attaque à la partie supérieure de la moelle cervicale (de C2 à C5) exposant à la paralysie diaphragmatique par atteinte du nerf phrénique. Cette forme redoutable peut ainsi nécessiter le recours à la ventilation mécanique. Elle peut conduire également à la paralysie des membres, à des troubles de la déglutition et de la fonction cardiaque[38].
Évolution
La guérison est la règle chez les sujets porteurs d'une poliomyélite abortive. En cas de méningite aseptique les symptômes peuvent persister de deux à dix jours mais l'évolution est presque toujours favorable.[39] En cas de poliomyélite spinale, la paralysie est définitive si l'innervation motrice du muscle est entièrement détruite. Les cellules endommagées mais survivantes peuvent récupérer une partie de leur fonctionnement quatre à six semaines après les premiers signes.[39] La moitié des patients atteints de poliomyélite spinale récupère totalement, un quart récupère avec des séquelles modérées et un quart présente un handicap sévère.[40] Le degré de paralysie à la phase aiguë et de paralysie résiduelle semble proportionnel à l'intensité de la virémie, et inversemment proportionnel au degré d'immunité.[26] La poliomyélite spinale est rarement mortelle.[34]
En l'absence d'assistance respiratoire, les formes s'accompagnant d'atteinte respiratoire évoluent vers les pneumopathies d'inhalation et vers l'asphyxie.[41] Au total, 5 à 10 % des poliomyélites paralytiques évoluent vers la mort par paralysie des muscles respiratoires. Le taux de mortalité varie selon l'âge : 2 à 5 % des enfants, 15 à 30 % des adultes décèdent des suites de la maladie.[27] La polio bulbaire est la plus meurtrière, constamment mortelle en l'absence de traitement et d'assistance respiratoire [38] et tuant 25 à 75 % des patients pris en charge.[27][42] La ventilation mécanique en pression positive, méthode de ventilation artificielle de référence à l'heure actuelle, permet de réduire la mortalité à 15 %.[43]
Diagnostic
Diagnostic clinique
Le diagnostic différentiel est très difficile dans les formes non paralytiques, la polio passant souvent pour une infection banale rhino-pharyngée ou digestive. La poliomyélite paralytique est cliniquement suspectée devant la survenue aiguë de paralysies flasques d'un ou de plusieurs membres avec diminution ou abolition des réflexes ostéo-tendineux, sans atteinte sensitive ni trouble des fonctions cognitives, et après exclusion d'une autre cause notamment inflammatoire (syndrome de Guillain-Barré, myélite aiguë transverse) ou mécanique (compression médullaire ou radiculaire, traumatisme).[44] Le diagnostic est évoqué facilement chez les autochtones des zones endémiques, plus rarement chez les sujets voyageurs non immunisés.
Diagnostic biologique
L'analyse du liquide céphalo-rachidien (LCR) recueilli par ponction lombaire révèle un liquide clair, une hypercytose modérée à prédominance de lymphocytes, une glycorachie normale, une protéinorachie normale ou modérément augmentée, traduisant une méningite aseptique. Répété 15 jours plus tard, l'examen montre généralement une régression du nombre de cellules et une majoration de la protéinorachie.[7]
La sérologie polio est sensible et précoce,[27] mais le diagnostic de certitude nécessite la mise en évidence directe du poliovirus sur un écouvillonnage pharyngé, dans les selles ou dans le LCR.[7] Celle-ci n'est pratiquée que de façon exceptionnelle en zone d'endémie car coûteuse et non indispensable. Elle s'avère nécessaire en revanche dans les cas douteux, et particulièrement dans les régions où la maladie a disparu. L'identification du matériel génétique viral par Polymerase chain reaction (PCR) permet en outre de distinguer les souches sauvages des souches vaccinales utilisées pour la vaccination orale.[45] Cette distinction est importante puisque pour chaque cas rapporté de poliomyélite paralytique, on estime qu'il existe 200 à 3 000 autres cas asymptomatiques mais contagieux.[46]
Traitement
 Patient souffrant de la polio placé dans un respirateur artificiel à pression négative (poumon d'acier)
Patient souffrant de la polio placé dans un respirateur artificiel à pression négative (poumon d'acier)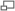
Il n'existe pas de traitement curatif de la poliomyélite. Les formes extra-neurologiques et les méningites aseptiques, si elles sont diagnostiquées comme telles, ne relèvent que de mesures symptomatiques. En cas de poliomyélite paralytique, les objectifs de la prise en charge thérapeutique portent sur l'atténuation des symptômes, l'accélération de la récupération et la prévention des complications. Le traitement comporte des antalgiques pour lutter contre la douleur, des antibiotiques pour traiter les surinfections bactériennes, l'exercice physique modéré et un régime alimentaire adapté.[47] Le traitement de la poliomyélite nécessite souvent une convalescence prolongée assortie d'une rééducation physique, de l'utilisation de prothèses, de chaussures orthopédiques et, dans certains cas, d'interventions orthopédiques.[37]
Les atteintes les plus sévères, notamment celles avec détresse respiratoire, nécessitent une prise en charge réanimatoire et peuvent nécessiter l'assistance ventilatoire à domicile à l'aide de respirateurs artificiels portatifs. Historiquement, le recours à la ventilation non invasive à pression négative, plus communément appelée poumon d'acier, a permis à des milliers de patients d'être ventilés de façon acceptable dans l'attente de la récupération d'une autonomie respiratoire (généralement au bout d'une à deux semaines dans les meilleurs cas).
Prévention
Sérothérapie
En 1950, William Hammon (Université de Pittsburgh) parvint à purifier des gamma globulines à partir du plasma sanguin des patients ayant guéri de la poliomyélite.[48] Hammon proposa l'injection de sérum anti-polio pour prévenir la maladie et réduire la sévérité des symptômes chez les patients atteints. Un grand essai clinique donna des résultats encourageants, laissant supposer que les gamma globulines anti-poliomyélitiques pouvaient prévenir la survenue d'une poliomyélite paralytique dans environ 80 % des cas.[49] Cependant l'immunisation passive par sérothérapie s'avéra impossible à mettre en œuvre à grande échelle, principalement en raison de la quantité insuffisante de sérum disponible. La recherche se détourna de cette stratégie et se focalisa sur la mise au point du vaccin.[50]
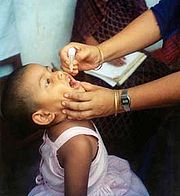
Vaccination antipoliomyélitique
Deux vaccins antipoliomyélitiques sont disponibles : l'un inactivé administré par injection sous-cutanée ou intra-musculaire, l'autre vivant atténué administré par voie orale. Les deux confèrent une immunité efficace contre l'infection à poliovirus et préviennent sa transmission de personne à personne. Ils permettent ainsi la protection individuelle et l'immunité collective.[51]
Vaccin inactivé
Le vaccin inactivé (souche Salk) fut développé en 1952 par Jonas Salk et officiellement annoncé le 12 avril 1955.[52] Il est élaboré à partir de poliovirus cultivé sur lignée cellulaire simienne, puis inactivé chimiquement par le formaldéhyde.[11] Il confère une immunité protectrice chez 90 % des sujets après deux injections et chez plus de 99 % des sujets après trois injections.[27] Trivalent, il protège contre les trois souches de poliovirus (PV1, PV2, PV3). Il peut être administré à partir de l'âge de six semaines.[53] Il n'expose à aucun effet indésirable sérieux et il n'a pas de contre-indication.[7] Dans les pays industrialisés, le vaccin inactivé est le plus employé : soit seul, soit combiné à la vaccination orale.[54]
Vaccin vivant atténué
Le vaccin vivant (souche Sabin) a été mis au point en 1957 par Albert Sabin. Il utilise un poliovirus vivant mais atténué par un passage répété dans des cellules non humaines à des températures infra-physiologiques.[55] Il a été testé dès 1957 et a été autorisé en 1962.[56] Administré par voie orale, il reproduit une infection digestive à bas bruit et entraîne la synthèse active d'anticorps protecteurs par la barrière digestive. La souche vaccinale est incapable de se répliquer efficacement dans le tissu nerveux chez le sujet immunocompétent.[57] Le vaccin vivant, trivalent, est d'efficacité comparable au vaccin atténué (95 % de protection après trois doses). Il peut être administré dès la naissance.[53] Il expose au risque théorique de poliomyélite vaccinale (1 cas sur 750 000).[13] Il est ainsi contre-indiqué, comme tout vaccin vivant, chez les sujets immunodéprimés et chez les femmes enceintes.[27] Peu coûteux, efficace et facile à administrer, le vaccin oral est le mieux adapté à la vaccination de masse et est le plus employé dans le monde, particulièrement dans les pays en voie de développement.[58]
Épidémiologie
Historique
Bien que les premières épidémies de poliomyélite n'aient été identifiées qu'au XXe siècle, le poliovirus est probablement pathogène pour l'homme depuis plusieurs millénaires [59]. Jusqu'aux années 1880 cependant, quand les premières épidémies ont frappé l'Europe, le poliovirus était un agent endémique et quiescent. À partir de 1910, les épidémies sont devenues régulières dans tout le monde industrialisé, principalement dans les villes et durant les mois d'été. Au faîte de sa propagation dans les années 1940 et 1950, on estime que la poliomyélite tuait ou paralysait plus d'un demi-million de personnes chaque année dans le monde [60]
Certaines gravures de l'Égypte antique représentent des personnages handicapés moteurs avec certaines caractéristiques de la poliomyélite (adultes aux membres amyotrophiés, enfants marchant à l'aide de cannes) [47]. Des théories avancent que l'empereur romain Claude, qui marcha avec un appui toute sa vie, aurait été frappé de poliomyélite dans son enfance [61]. Le cas de sir Walter Scott, qui présenta à l'âge de deux ans au cours de sa poussée dentaire « une fièvre sévère qui le priva de la force de sa jambe droite » [62], semble être rétrospectivement un cas de poliomyélite. À cette époque, la maladie était inconnue de la médecine. Le diagnostic rétrospectif est probable grâce à la description détaillée qu'en fit Scott [63].
Les symptômes de la poliomyélite ont été décrits successivement, au début du XIXe siècle, sous les noms de paralysie dentaire, paralysie spinale infantile, paralysie essentielle de l'enfant, paralysie régressive, myélite des cornes antérieures, téphromyélite (du grec tephros, « cendre grise ») et paralysie du matin [64]. Le médecin britannique Michael Underwood donna en 1789 une première description sémiologique de la poliomyélite sous le nom de « débilité des extrémités inférieures » [65].
Vers 1880, l'amélioration de l'hygiène conduit à réduire les infections immunisantes naturelles au poliovirus chez le jeune enfant. Les premiers cas cliniques apparaissent dans le nord de l'Europe.
La maladie frappe la région de New York en 1916. En 1952, plus de 50 000 personnes sont touchées aux États-Unis, en France la polio fait une victime pour 100 000 habitants.
Les premiers essais du vaccin injectable de Jonas Salk sont réalisé en 1954. La première campagne de vaccination de masse a été marquée par la fourniture d'un important lot défectueux (virus vivant non atténué) aboutissant à près de 220 000 contaminations dont 70 000 malades, 164 paralysies sévères et 10 décès [66]
Albert Sabin crée un vaccin oral en 1961.
Une épidémie est enrayée aux États-Unis en 1965. Le taux de nouvelles contaminations est tombé à 1 pour 10 millions de personnes.
Programme d'éradication
En 1988, la Quarante et Unième Assemblée mondiale de la Santé, composée alors des délégués de 166 États Membres, a adopté une résolution visant l’éradication de la poliomyélite dans le monde. C’est ainsi que l’Initiative mondiale pour l’éradication de la poliomyélite est née, sous la direction de l’Organisation mondiale de la Santé (OMS), de l’UNICEF, des Centers for Disease Control and Prevention des États-Unis d’Amérique (CDC) et du Rotary International (Global Polio Eradication Initiative) Cette initiative a été mise sur pied à la suite de la certification de l’éradication de la variole en 1980, des progrès accomplis au cours des années 80 grâce aux opérations d’élimination du poliovirus dans les Amériques et de l’engagement pris par Rotary International de mobiliser des fonds pour protéger tous les enfants de cette maladie. Cette initiative a été lancée en vue d'éradiquer la poliomyélite vers l'année 2005. La cible a été secondairement retardée à 2010.
En 1992 est découvert un foyer de polio aux Pays-Bas, dans un groupe qui refuse la vaccination.
Fin 1999 le nombre de cas avait reculé de 95 % avec 7 094 nouveaux cas recensés pour 20 000 malades au total et le nombre de pays atteints est passé de 125 à 30, disparaissant de tout le continent américain, du Pacifique occidental, de la Chine et de l'Europe.
L'année 2004 a connu une augmentation des cas de polio (1 300 contre 800 en 2003). Le nombre de cas déclaré en 2005 atteint 1 650 et dépasse 1 760 cas en 2006[67].
La maladie reste un important problème de santé publique pour de nombreux pays d'Afrique et d'Asie, où elle reste présente de manière préoccupante en Afghanistan, en Égypte, en Inde (plus de 500 cas en 2006), au Niger, au Nigeria (près de 1 000 cas en 2006) et au Pakistan.
Les causes de cette stagnation, voire de cette régression sont complexes. Elles sont dues aux problèmes récurrents d'accès à l'eau potable, à l'insalubrité, ainsi qu'au retard pris par les campagnes de vaccination dans deux États (État de Kano et Zamfara) au nord du Nigeria, où les responsables lancent des rumeurs accusant les Américains de vouloir les contaminer par le SIDA et de les rendre stériles.
La maladie est également réapparue en Indonésie ; 225 cas ont été diagnostiqués en 2004. Une grande campagne de 24 millions de vaccinations en un jour a été réalisée le 29 août 2005 avec une mobilisation médiatique sans précédent dans le pays. Le dernier cas décrit dans ce pays date de février 2006.
Pour mettre en oeuvre l’effort intensifié d’éradication de la poliomyélite en 2007-2008, le financement classique par les partenaires de l’aide au développement a été largement complété par des ressources intérieures des pays d’endémie restants. Le Gouvernement indien a engagé, le lendemain de l’adoption de l’effort intensifié d’éradication de la poliomyélite en 2007-2008. Le Gouvernement du Nigéria a annoncé en 2007 son intention de verser US $ 32 millions en faveur de son programme national d’éradication de la poliomyélite et a versé, en décembre 2008, US $ 19 millions sur le montant qu’il s’était engagé à verser. Le Gouvernement pakistanais s’est engagé à verser US $ 35 millions sur ses ressources intérieures pour le VPO à l’occasion des activités de vaccination supplémentaires en2008, tout en étudiant des modalités pour pouvoir apporter un financement supplémentaire du VPO en 2009-2010. Exprimant leur confiance dans l’effort intensifié d’ éradication, le Rotary International et la Fondation Bill & Melinda Gates ont annoncé en novembre 2007 un partenariat destiné à injecter US $ 200 millions dans l’Initiative Le 21 janvier 2009, une deuxième contribution a été annoncée par ces organisations du secteur privé, revenant à ajouter US $ 355 millions à leur contribution initiale. La contribution du Rotary à l’Initiative, grâce à ce partenariat de financement, dépassera US $ 1,2 milliard[68]. Les cas sont essentiellement confinés géographiquement aux endroits où la couverture vaccinale est sub-optimale (30 % d'enfants non vaccinés au Nigéria, les cas indiens étant limitées également à une région réticente aux vaccinations). La présence de cas sporadiques chez des personnes dûment vaccinées soulève des questions [69].
Épidémiologie actuelle
Facteurs de risque
- l'âge
- touche plus les hommes que les femmes
- grossesse
- exercice musculaire et fatigue musculaire
- injection intramusculaire
- déficit immunitaire congénital
- amygdalectomie
- facteurs génétiques (chromosome 19)
Le syndrome post-polio
Trente à quarante ans après la phase aiguë de la maladie, alors que leur état général était depuis longtemps stabilisé, les malades ressentent une grande fatigue, une faiblesse musculaire progressive et des douleurs articulaires. Parfois ces symptômes s'accompagnent de difficultés respiratoires ou d'atrophie musculaire.
Le syndrome post-polio a été décrit pour la première fois par les neurologues Jean-Martin Charcot et Fulgence Raymond en 1875. Il touche environ un survivant sur deux.
Malades célèbres
- Franklin Delano Roosevelt pensait avoir été atteint en 1921; il avait en fait un syndrome de Guillain-Barré.
- Pierre Fournier
- Xavier Haas
- Frida Kahlo
- Itzhak Perlman
- Milton Erickson
- les membres du groupe Israel Vibration
- Guy Crescent
- Arthur C. Clarke
- Francis Ford Coppola
- Pier-Giorgio Frassati
Référence
- ↑ a , b , c et d (en)Chamberlin SL, Narins B, The Gale Encyclopedia of Neurological Disorders, Thomson Gale, Detroit, 2005, 1011 p. (ISBN 0-7876-9150-X)
- ↑ a et b (en)Cohen JI, Harrison's Principles of Internal Medicine, McGraw-Hill Professional, 16e Édition, 2004, 2607 p. (ISBN 0-0714-0235-7), chap. 175 (« Enteroviruses and Reoviruses »), p. 1144
- ↑ a , b et c (en)Ryan KJ, Ray CG, Sherris Medical Microbiology, McGraw Hill, 4e Édition, 2004, 992 p. (ISBN 0-8385-8529-9), « Enteroviruses », p. 535-7
- ↑ (en)Paul JR, A History of Poliomyelitis, Yale University Press, New Haven, Conn, 1971, 496 p. (ISBN 0-300-01324-8), p. 16–18
- ↑ Poliomyélite sur Organisation mondiale de la Santé, 2008. Consulté le 22-03-2009
- ↑ Éradiquer la polio sur Unicef, 2008. Consulté le 22-03-2009
- ↑ a , b , c , d , e , f , g , h et i E. Pilly, Collège des universitaires de Maladies Infectieuses et Tropicales, Maladies infectieuses et tropicales, Vivactis Plus Ed, Paris, 20e Édition, 2006, 747 p. (ISBN 2-9522954-1-7), « Infections à entérovirus », p. 518-19
- ↑ a et b Relevé Épidémiologique hebdomadaire, vol. 83, 47 (pp. 421-428) sur Organisation mondiale de la Santé, 21 novembre 2008. Consulté le 25-05-2009
- ↑ (en)Katz SL, Gershon AA, Krugman S, Hotez PJ, Krugman's infectious diseases of children, Mosby, St-Louis, 2004, 822 p. (ISBN 0-323-01756-8), p. 81–97
- ↑ a , b et c (en)Ohri LK, Marquess JG, « Polio: Will We Soon Vanquish an Old Enemy? », dans Drug Benefit Trends, vol. 11, no 6, 1999, p. 41–54
- ↑ a , b , c , d , e et f (en)Kew O, Sutter R, de Gourville E, Dowdle W, Pallansch M, « Vaccine-derived polioviruses and the endgame strategy for global polio eradication », dans Annu Rev Microbiol, vol. 59, 2005, p. 587–635 [lien PMID lien DOI]
- ↑ a et b (en)Parker SP, McGraw-Hill Concise Encyclopedia of Science & Technology, McGraw-Hill, New York, 1998, 2450 p. (ISBN 0-07-052659-1), p. 67
- ↑ a , b et c Racaniello V, « One hundred years of poliovirus pathogenesis », dans Virology, vol. 344, no 1, 2006, p. 9–16 [lien PMID lien DOI]
- ↑ Davis L, Bodian D, Price D, Butler I, Vickers J, « Chronic progressive poliomyelitis secondary to vaccination of an immunodeficient child », dans N Engl J Med, vol. 297, no 5, 1977, p. 241–5 [lien PMID]
- ↑ Chandra R, « Reduced secretory antibody response to live attenuated measles and poliovirus vaccines in malnourished children », dans Br Med J, vol. 2, no 5971, 1975, p. 583–5 [lien PMID]
- ↑ Miller A, « Incidence of poliomyelitis; the effect of tonsillectomy and other operations on the nose and throat », dans Calif Med, vol. 77, no 1, July 1952, p. 19–21 [lien PMID]
- ↑ Horstmann D, « Acute poliomyelitis relation of physical activity at the time of onset to the course of the disease », dans J Am Med Assoc, vol. 142, no 4, 1950, p. 236–41 [lien PMID]
- ↑ Gromeier M, Wimmer E, « Mechanism of injury-provoked poliomyelitis », dans J. Virol., vol. 72, no 6, 1998, p. 5056–60 [lien PMID]
- ↑ Evans C, « Factors influencing the occurrence of illness during naturally acquired poliomyelitis virus infections », dans Bacteriol Rev, vol. 24, no 4, 1960, p. 341–52 [[pdf] texte intégral lien PMID]
- ↑ (en)Salisbury A, Ramsay M, Noakes K (Joint Committee on Vaccination and Immunisation), Immunisation Against Infectious Disease, 2006, Stationery Office, Édimbourg, 2006, 468 p. (ISBN 0-11-322528-8), chap. 26 (« Poliomyelitis »), p. 313–29
- ↑ Sauerbrei A, Groh A, Bischoff A, Prager J, Wutzler P, « Antibodies against vaccine-preventable diseases in pregnant women and their offspring in the eastern part of Germany », dans Med Microbiol Immunol, vol. 190, no 4, 2002, p. 167–72 [lien PMID lien DOI]
- ↑ He Y, Mueller S, Chipman P, et al, « Complexes of poliovirus serotypes with their common cellular receptor, CD155 », dans J Virol, vol. 77, no 8, 2003, p. 4827–35 [texte intégral lien PMID lien DOI]
- ↑ a et b (en) Yin-Murphy M, Almond JW, Baron's Medical Microbiology (Baron S et al, eds.), Univ of Texas Medical Branch, 1996 (ISBN 0-9631172-1-1), « Picornaviruses: The Enteroviruses: Polioviruses »
- ↑ (en)Todar K, « Polio », 2006
- ↑ Sabin A, « Pathogenesis of poliomyelitis; reappraisal in the light of new data », dans Science, vol. 123, no 3209, 1956, p. 1151–7 [lien PMID lien DOI]
- ↑ a , b , c et d Mueller S, Wimmer E, Cello J, « Poliovirus and poliomyelitis: a tale of guts, brains, and an accidental event », dans Virus Res, vol. 111, no 2, 2005, p. 175–93 [lien PMID lien DOI]
- ↑ Erreur de citation : Balise
<ref>incorrecte ; aucun texte n’a été fourni pour les références nomméesPinkBook. - ↑ Falconer M, Bollenbach E, « Late functional loss in nonparalytic polio », dans American journal of physical medicine & rehabilitation / Association of Academic Physiatrists, vol. 79, no 1, 2000, p. 19–23 [lien PMID lien DOI]
- ↑ a et b (en) Leboeuf C, The late effects of Polio: Information For Health Care Providers., Commonwealth Department of Community Services and Health, 1992 (ISBN 1-875412-05-0)
- ↑ (en) Wood, Lawrence D. H.; Hall, Jesse B.; Schmidt, Gregory D., Principles of Critical Care, McGraw-Hill Professional, 2005 (ISBN 0-07-141640-4), p. 870
- ↑ Gawne AC, Halstead LS, « Post-polio syndrome: pathophysiology and clinical management », dans Critical Review in Physical Medicine and Rehabilitation, vol. 7, 1995, p. 147–88 [texte intégral] Reproduced online with permission by Lincolnshire Post-Polio Library; retrieved on 2007-11-10.
- ↑ Young GR, « Occupational therapy and the postpolio syndrome », dans The American journal of occupational therapy, vol. 43, no 2, 1989, p. 97–103 [texte intégral lien PMID]
- ↑ Nathanson N, Martin J, « The epidemiology of poliomyelitis: enigmas surrounding its appearance, epidemicity, and disappearance », dans Am J Epidemiol, vol. 110, no 6, 1979, p. 672–92 [lien PMID]
- ↑ a et b (en) Silverstein A, Silverstein V, Nunn LS, Polio, Enslow Publishers, Berkeley Heights, NJ, 2001 (ISBN 0-7660-1592-0), p. 12
- ↑ a et b (en) Frauenthal HWA, Manning JVV, Manual of infantile paralysis, with modern methods of treatment., Philadelphia Davis, 1914 (OCLC 2078290), p. 79–101
- ↑ a , b et c (en) Cono J, Alexander LN, Vaccine Preventable Disease Surveillance Manual, Centers for Disease Control and Prevention, 2002, « Chapter 10, Poliomyelitis. », p. 10–1
- ↑ a et b (en) Professional Guide to Diseases (Professional Guide Series), Lippincott Williams & Wilkins, Hagerstown, MD, 2005 (ISBN 1-58255-370-X), p. 243–5
- ↑ a et b (en) Hoyt, William Graves; Miller, Neil; Walsh, Frank, Walsh and Hoyt's clinical neuro-ophthalmology, Lippincott Williams & Wilkins, Hagerstown, MD, 2005 (ISBN 0-7817-4814-3), p. 3264–65
- ↑ a et b Neumann D, « Polio: its impact on the people of the United States and the emerging profession of physical therapy », dans The Journal of orthopaedic and sports physical therapy, vol. 34, no 8, 2004, p. 479–92 [[pdf] texte intégral lien PMID] Reproduced online with permission by Post-Polio Health International; retrieved on 2007-11-10.
- ↑ (en) Cuccurullo SJ, Physical Medicine and Rehabilitation Board Review, Demos Medical Publishing, 2004 (ISBN 1-888799-45-5)
- ↑ Goldberg A, « Noninvasive mechanical ventilation at home: building upon the tradition », dans Chest, vol. 121, no 2, 2002, p. 321–4 [lien PMID lien DOI]
- ↑ Miller AH, Buck LS, « Tracheotomy in bulbar poliomyelitis », dans California medicine, vol. 72, no 1, 1950, p. 34–6 [lien PMID]
- ↑ Modèle:Cite paper
- ↑ « Case definitions for infectious conditions under public health surveillance. Centers for Disease Control and Prevention », dans Morbidity and mortality weekly report, vol. 46, no RR-10, 1997, p. 26–7 [[pdf] texte intégral lien PMID]
- ↑ Chezzi C, « Rapid diagnosis of poliovirus infection by PCR amplification », dans J Clin Microbiol, vol. 34, no 7, July 1996, p. 1722–5 [lien PMID]
- ↑ Gawande A, « The mop-up: eradicating polio from the planet, one child at a time », dans {{{périodique}}}, 2004-01-12, p. 34–40 (ISSN 0028-792X)
- ↑ a et b (en) Daniel, Thomas M.; Robbins, Frederick C., Polio, University of Rochester Press, Rochester, N.Y., USA, 1997 (ISBN 1-58046-066-6), p. 8–10
- ↑ Hammon W, « Passive immunization against poliomyelitis », dans Monogr Ser World Health Organ, vol. 26, 1955, p. 357–70 [lien PMID]
- ↑ Hammon W, Coriell L, Ludwig E, et al, « Evaluation of Red Cross gamma globulin as a prophylactic agent for poliomyelitis. 5. Reanalysis of results based on laboratory-confirmed cases », dans J Am Med Assoc, vol. 156, no 1, 1954, p. 21–7 [lien PMID]
- ↑ Rinaldo C, « Passive immunization against poliomyelitis: the Hammon gamma globulin field trials, 1951–1953 », dans Am J Public Health, vol. 95, no 5, 2005, p. 790–9 [lien PMID]
- ↑ Fine P, Carneiro I, « Transmissibility and persistence of oral polio vaccine viruses: implications for the global poliomyelitis eradication initiative », dans Am J Epidemiol, vol. 150, no 10, 1999, p. 1001–21 [texte intégral lien PMID]
- ↑ Spice B : Tireless polio research effort bears fruit and indignation, The Salk vaccine: 50 years later/ second of two parts, Pittsburgh Post-Gazette (April 4, 2005). Consulté le 2008-08-23.
- ↑ a et b E. Pilly, Collège des universitaires de Maladies Infectieuses et Tropicales, Maladies infectieuses et tropicales, Vivactis Plus Ed, Paris, 2006, 747 p. (ISBN 2-9522954-1-7), « Vaccinations », p. 148-56
- ↑ WHO: Vaccines for routine use. Consulté le 23-08-2008
- ↑ Sabin AB, Boulger LR, « History of Sabin attenuated poliovirus oral live vaccine strains », dans J Biol Stand, vol. 1, 1973, p. 115–8 [lien DOI]
- ↑ A Science Odyssey: People and Discoveries, 1998, PBS. Consulté le 23-08-2008
- ↑ Sabin A, Ramos-Alvarez M, Alvarez-Amezquita J, et al, « Live, orally given poliovirus vaccine. Effects of rapid mass immunization on population under conditions of massive enteric infection with other viruses », dans JAMA, vol. 173, 1960, p. 1521–6 [lien PMID]
- ↑ « Poliomyelitis prevention: recommendations for use of inactivated poliovirus vaccine and live oral poliovirus vaccine. American Academy of Pediatrics Committee on Infectious Diseases », dans Pediatrics, vol. 99, no 2, 1997, p. 300–5 [texte intégral lien PMID lien DOI]
- ↑ Trevelyan B, Smallman-Raynor M, Cliff A, « The Spatial Dynamics of Poliomyelitis in the United States: From Epidemic Emergence to Vaccine-Induced Retreat, 1910-1971 », dans Ann Assoc Am Geogr, vol. 95, no 2, 2005, p. 269–293 [lien PMID lien DOI]
- ↑ What is Polio, Canadian International Immunization Initiative. Consulté le 26-05-2009
- ↑ (en) Shell M, Stutter, Harvard University Press, Cambridge, 2005 (ISBN 0-674-01937-7), « Hamlet's Pause », p. 187–188
- ↑ (en) Collier, William Douglas, A history of English literature, in a series of biographical sketches, J. Campbell, Toronto, 1872 (ISBN 0-665-26955-2), p. 400
- ↑ Cone TE, « Was Sir Walter Scott's lameness caused by poliomyelitis? », dans Pediatrics, vol. 51, no 1, 1973, p. 35 [lien PMID]
- ↑ (en) Gould T, A Summer Plague: Polio and its Survivors, Yale University Press, 1995 (ISBN 0300062923), « Chapter One »
- ↑ (en) Underwood M, Debility of the lower extremities. In: A treatise on the dieases [sic] of children, with general directions for the management of infants from the birth (1789), vol. 2, Printed by T. Dobson, no. 41, South Second-Street, Philadelphia, 1793, p. 254–6
- ↑ The Cutter incident, Paul Offit, Yale University Press, ISBN 0-300-10864-8
- ↑ (en)Comptabilité des nouveaux cas de polyomyélites
- ↑ http://www.polioeradication.org/content/general/FinalFRR_French2009-2013_January09.pdf Initiative mondiale pour l’éradication de la poliomyélite : Implications budgétaires du plan stratégique de l’Initiative mondiale pour l’éradication de la poliomyélite et ressources financières nécessaires
- ↑ (en)The eradication of polio — progress and challenges, Mark A. Pallansch, Hardeep S. Sandhu, New Eng J Med, 2006;355;24;2508-2511
Liens externes
- (en) Global Polio Eradication Initiative, site officiel du programme d'éradication de la polio dans le monde
- (fr) Zone d'endémie de la poliomyélite, sur le site du CHU de Rouen
- Portail de la médecine
- Portail des maladies infectieuses
Catégories : Infection virale | Infection du système nerveux | Maladie en pédiatrie | Maladie de la moelle épinière
Wikimedia Foundation. 2010.