- Puits de carbone
-
 Pour les articles homonymes, voir Puits.Le bois, mais aussi le sol et une partie de la nécromasse végétale, animale, fongique et microbienne des forêts tempérées constituent le puits de carbone le plus important pour les terres émergées.
Pour les articles homonymes, voir Puits.Le bois, mais aussi le sol et une partie de la nécromasse végétale, animale, fongique et microbienne des forêts tempérées constituent le puits de carbone le plus important pour les terres émergées.
 Les récifs corraliens, et certains planctons produisent le carbonate de calcium qui constitue le principal puits de carbone océanique et planétaire
Les récifs corraliens, et certains planctons produisent le carbonate de calcium qui constitue le principal puits de carbone océanique et planétaire
Au sens large, un puits de carbone ou puits CO2 est un réservoir, naturel, ou artificiel de carbone qui absorbe le carbone de l'atmosphère et donc contribue à diminuer la quantité de CO2 atmosphérique. La taille de ces réservoirs augmente constamment, à l'inverse d'une source de carbone. Les principaux puits étaient les processus biologiques de production de charbon, pétrole, gaz naturels, hydrates de méthane et roches calcaires. Ce sont aujourd'hui les océans, les sols (humus, tourbière) et certains milieux végétalistes (forêt en formation).
La séquestration du carbone (ou piégeage, ou emprisonnement du carbone) désigne les processus extrayant le carbone ou le CO2 de l'atmosphère terrestre et le stockant dans un puits de carbone.
La photosynthèse est la base du mécanisme naturel de séquestration du carbone. Les bactéries photosynthétiques, les plantes et la chaine alimentaire ainsi que la nécromasse qui en dépendent sont considérées comme des puits de carbone pour la partie « piégée » du carbone.
En France, la loi Grenelle II prévoit[1] qu'un rapport du Gouvernement au Parlement portera sur « l’évaluation des puits de carbone retenu par les massifs forestiers » et leur « possible valorisation financière pour les territoires » (art 83).Sommaire
Éléments de définition (dans le cadre du marché du carbone)
Le concept de puits de carbone s'est diffusé avec le Protocole de Kyōto créé dans le but de réduire les concentrations élevées et croissantes de CO2 atmosphériques et ainsi lutter contre le réchauffement climatique.
Diverses voies sont explorées pour améliorer la séquestration naturelle du carbone, et développer des techniques (naturelles ou artificielles) de capture et stockage du carbone.
En 2000, le GIEC a défini le puits de carbone comme « tout processus ou mécanisme qui absorbe un gaz à effet de serre, tels le CO2 et le CH4, [...] présent dans l’atmosphère »<ref>GIEC, Utilisation des terres, changements d'affectation et foresterie, Giec, 2000</ref>).Un puits de carbone ne vise pas à réduire les émissions de CO2. C'est un lieu de piégeage naturel (ou renforcé pour ce faire par l'homme). Le stockage géologique du CO2 devrait même augmenter les émissions globales de CO2 car cette activité consommera inévitablement de l'énergie (qui produira du CO2) ; mais - à condition que ces puits ne "fuient" pas - la quantité de CO2 nécessaire à cette activité sera moindre que celle emprisonnée, diminuant le bilan CO2 du cycle (le temps de son piégeage), même si la quantité de CO2 dans le cycle est augmentée.
Puits naturels
Forêts
L'écosystème forestier (et en particulier le système arbre/sol) est après le plancton océanique et avec les tourbières et les prairies, le principal puits de carbone naturel planétaire, essentiel au cycle du carbone. Il accumule d'énormes quantités de carbone dans le bois, les racines, le sol et l'écosystème via la photosynthèse. L'ONU/FAO estime que « l'expansion des plantations d'arbres pourrait compenser « 15 % des émissions de carbone des combustibles fossiles » dans la première moitié du XXIe siècle sous réserve qu'elles ne le relarguent pas prématurément[3], et qu'on ait pas surestimé les surfaces enforestées et leur capacité de stockage[3] et qu'il ne s'agisse pas que de plantation d'essences à croissance rapide[3].
En effet, les plantes absorbent le CO2 de l'atmosphère, stockant une partie du carbone prélevée et rejetant de l'oxygène dans l'atmosphère. Chez les arbres, les essences pionnières, à croissance rapide (ex : Peuplier, saule ou bouleau en zone tempérée, Bois-canon (creux, à la manière du bambou) en zone tropicale), n'absorbent généralement que peu de carbone et le relarguent vite et facilement. Au contraire, les bois durs et denses en contiennent beaucoup plus, et pour le plus longtemps, mais ils croissent généralement bien plus lentement (siècles à millénaires pour les « très gros bois »). À maturité, l'absorption est moindre, mais le carbone représente 20 % de leur poids (en moyenne, et jusqu'à 50 % et plus pour des bois denses tropicaux).
Quand l'arbre meurt, il est décomposé par des communautés saproxylophages (bactéries, champignons et invertébrés) qui recyclent son carbone sous forme de biomasse, nécromasse (cadavres, excrétats et excréments de ces organismes) et sous forme de gaz (CO2, méthane, libérés dans l'atmosphère ou l'eau). La forêt et d'autres écosystèmes continueront à stocker ou recycler ce carbone via une régénération naturelle. Toutes les forêts tempérées (hors incendies et exploitation) accumulent le carbone. Une grande partie des forêts tropicales (hors forêts tourbeuses) sont réputées à l'équilibre (source=puits), et les forêts boréales jouent un rôle plus complexe (plus sensibles aux défoliations et au feu).Il arrive localement que les arbres morts, roseaux et plantes des marais se décomposent lentement et imparfaitement, en conditions anaérobies, sous la surface du marais, produisant des tourbes. Le mécanisme est suffisamment lent pour que, dans la plupart des cas, le marais grandisse assez vite et permette de fixer plus de carbone atmosphérique que ce qui est libéré par la décomposition. Un quart du carbone absorbé par les forêts l'est par les plantes et le sol[4].
Pour l'ONU, la FAO, pour ses statistiques et inventaires forestiers, distingue[5] 4 différents stock de carbone :
- la biomasse aérienne ; « Carbone présent dans toute la biomasse vivante au-dessus du sol, y compris les tiges, les souches, les branches, l’écorce, les graines et le feuillage » [5];
- la biomasse souterraine ; « Carbone présent dans toute la biomasse de racines vivantes. Les radicelles de moins de deux mm de diamètre sont exclues car il est souvent difficile de les distinguer empiriquement de la matière organique du sol ou de la litière »[5] ;
- Le Carbone du bois mort ; de la nécromasse ligneuse - hors de la litière - « soit sur pied, soit gisant au sol, soit dans le sol. Le bois mort comprend le bois gisant à la surface, les racines mortes et les souches dont le diamètre est supérieur ou égal à dix cm ou tout autre diamètre utilisé par le pays » [5] ;
- le carbone de la litière ; « Carbone présent dans toute la biomasse non vivante dont le diamètre est inférieur au diamètre minimal pour le bois mort (p. ex. dix cm), gisant à différents stades de décomposition au-dessus du sol minéral ou organique »[5].
- le carbone dans le sol ; « Carbone organique présent dans les sols minéraux et organiques (y compris les tourbières) jusqu’à une profondeur spécifique indiquée par le pays et appliquée de façon cohérente à travers toutes les séries chronologiques »[5].
Remarque : Dans un contexte climatique incertain, certaines forêts plus vulnérables pourraient parfois devenir des « sources » de CO2 (le contraire d'un puits de carbone), notamment en cas d'incendie, ou provisoirement après les grands chablis couchés par de fortes tempêtes ou après les grandes coupes rases. Certaines techniques de génie écologique (BRF, conservation de gros bois-mort, réintroduction du Castor, restauration de zones humides et tourbières, etc.) peuvent contribuer à augmenter la résilience écologique de certaines forêts (Europe, Canada, Amérique du Nord...).
Forêt française, stock et puits de carbone
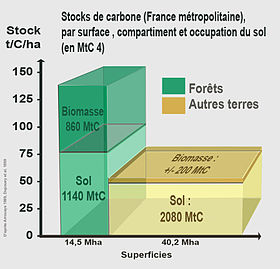
Dans le monde la forêt métropolitaine française compte peu en termes de stock de carbone, mais à l'échelle du pays elle joue un rôle très important, très variable cependant selon les régions[3]. De plus, elle est en augmentation surfacique, mais après une longue phase de régression.
En termes quantitatifs, différentes estimations ont été faites pour la France métropolitaine. Un premier chiffrage de 2 milliards de tonnes environ (en 1990[6]) a été porté en 2004[7] à 2,5 Milliards de tonnes de carbone (soit l’équivalent de 9,2 Milliards de tonnes de CO2 absorbé). Cette quantité de carbone serait stockée pour moitié dans les sols (litière + humus) et plus provisoirement peut-être pour moitié dans les arbres (feuilles, branches, racines y compris) [7]. Seule une petite partie de ce carbone peut être considéré comme durablement stockée.
En termes de monétarisation, de 2000 à 2004, environ 24,4 millions de tonnes (Mt)/an de carbone auraient ainsi été provisoirement séquestrées par les arbres et les sols forestiers (89 Mt/an de CO2). Le prix de la tonne de CO2 stockée a chuté de 32 € en avril 2006, puis 0,20 € en 2007), ce serait 0,6 Md d’euros, 2,8 Mds d’euros et 0,02 Md d’euros économisés[7]. Cette variation des prix dictée par le marché ne permet pas d'évaluer la valeur financière de la fonction puits de carbone des forêts, mais cette valeur devrait a priori augmenter avec le temps.La filière bois, selon la durée de vie du bois extrait et manufacturé, contribue ou non à la lutte contre le réchauffement climatique. Elle a en 2004 utilisé 98 Mt de carbone (équivalant 359 Mt de CO2) mais dont une partie (papier, carton, cagettes, etc.) ne contribue pas à stocker du carbone[7].
Océans
 Le blanchiment des récifs coralliens (ici à la Réunion) a des causes encore mal comprise, peut-être liée à des microbes, à l'eutrophisation, l'acidification des eaux et/ou aux prémisses de changement climatique. Il préoccupe les experts du monde entier
Le blanchiment des récifs coralliens (ici à la Réunion) a des causes encore mal comprise, peut-être liée à des microbes, à l'eutrophisation, l'acidification des eaux et/ou aux prémisses de changement climatique. Il préoccupe les experts du monde entier
Les océans sont les principaux puits naturels de carbone, assimilé via le plancton, les coraux et les poissons, puis transformé en roche sédimentaire ou biogénique. Ils absorberaient environ 50 % du carbone émis dans l'air (sous forme de carbone dissous ou minéral).
Mais 50 % environ des coraux des eaux chaudes semblent malades ou morts ces dernières décennies, et lorsque le niveau de CO2 s'accroît au delà d'un seuil critique dans l'atmosphère, en augmentant également l'acidité des eaux marines, créant potentiellement de désastreux océans acides qui pourraient tuer le plancton qui piégeait le mieux le carbone, et rendant l'océan plus acide encore. De plus des zones mortes s'étendent dans les océans, qui deviennent émettrices de carbone ou de méthane. Les mers contiennent une quantité variable de CO2 dissoute, fonction de la biomasse et de la nécromasse, de la disponibilité en nutriments, de la température et de la pression.
Le phytoplancton marin, à l'instar des arbres, utilise la photosynthèse pour extraire le carbone du CO2. Il est le point de départ de la chaîne alimentaire océanique. Le plancton et d'autres organismes marins utilisent le CO2 dissous dans l'eau ou prélevé dans leur nourriture pour constituer leurs squelettes et coquilles à base de calcaire minéral, CaCO3. Ce mécanisme élimine le CO2 contenu dans l'eau et favorise la dissolution de celui contenu dans l'air. Les squelettes et coquilles calcaires ainsi que le "carbone organique" (nécromasse, excrétats et excréments) de ces organismes tombent finalement en une « pluie » continue (dite « Neige marine ») dans les fonds marins où ils sédimentent pour lentement former des roches sédimentaires. Le carbone des cellules du plancton doit être immergé entre 2000 et 4000 mètres de profondeur pour être emprisonné pour plusieurs milliers à millions ou milliards d'années sous forme de roche, les sédiments superficiels étant pour partie brassés, remis en suspension et réutilisés comme nutriments par la biosphère.Résultats contradictoires sur l'état et capacités des puits de carbone océaniques
- Une étude qui cherchait à affiner la mesure de la dissolution récente du CO2 dans l'océan (utilisant les chlorofluorocarbones comme marqueurs), publiée en 2003 laissait penser que la capacité des océans à absorber le CO2 avait été sous-estimée[8], cependant ceci est aussi le signe d'une accélération de l'acidification des océans qui peut mettre en péril le puits de carbone océanique et se traduire par un relargage de CO2.
- Inversement, des travaux récents concluent à une émission importante de CO2 et de méthane par les estuaires, et à une saturation du puits océanique pour l'hémisphère sud, ou plutôt à une dégradation de la capacité de ces mers à pomper du carbone en raison des changements climatiques qui affectent les vents et l'agitation de l'eau. Selon Nicolas Metzl et son équipe, les mesures faites de 1998 à 2007 par le service d'observation de l'océan indien (OISO) et les données accumulées depuis 1991 montrent que le taux de CO2 a augmenté plus vite dans les eaux de surface de cet océan que dans l'air (sachant que la diffusion du CO2 dépend de la température et de la différence de concentration dans l'air et l'eau). Cependant, les vents ont augmenté dans l'hémisphère sud, induisant un brassage des eaux de surface qui leur font perdre du CO2, et qui induisent un mélange avec les eaux profondes plus riche en CO2. Le puits de carbone de l'océan indien pourraient donc être environ 10 fois moins efficace qu'on ne l'avait antérieurement estimé.
Un autre programme, européen, CARBOOCEAN a également conclu à une situation mauvaise au nord : la capacité de puits de CO2 aurait été divisée par deux aux latitudes élevées de l'hémisphère nord, depuis 1996.
Les hydrates de méthane piégés dans l'océan sont également un facteur à prendre en compte en cas de début de réchauffement marqué, qu'ils pourraient accélérer.
Ces quatre éléments, sous réserve de confirmation pourraient significativement modifier les modélisations quand elles les intègreront[9]. - Une étude[10]. du début 2009 a montré qu'on avait fortement sous-estimé l'importance des poissons qui, par leur capacité à constamment produire dans leur intestin des carbonates peu solubles contribue aussi à séquestrer du carbone des eaux marines. Par exemple, le flet européen synthétise et rejette chaque heure et en moyenne 18 micromoles de carbone par kg de poisson (sous forme de calcite)[10]. Les poissons contribueraient ainsi à 3 %[11] à 15 %[12] du puits de carbone océanique (voire 45 % si l'on prenait les hypothèses les plus "optimistes")[10]. De plus, un climat chaud associé à la surpêche tendent à réduire le nombre de grands poissons ; or, une petite taille du poisson et un eau plus chaude favorisent la formation de carbonates de calcium ou de magnésium (qui sont éliminés avec la nécromasse, les fèces ou des boulettes de mucus)[10].
Hélas, ces carbonates plus riche en magnésium sont aussi plus solubles à grande profondeur. Ils peuvent alors relarguer une partie de leur carbone, mais en tamponnant le milieu, au point que cela pourrait expliquer jusqu'à un quart de l'augmentation de l'alcalinité titrable des eaux marines dans les 1000 mètres sous la surface (cette anomalie de dureté de l'eau était jusqu'ici controversée car non expliquée par les océanographes)[10]).
Hélas encore, c'est aussi dans les zones les plus favorables à ce piégeage du carbone (plateaux continentaux où se concentre environ 80 % de la biomasse en poisson) que la surpêche est la plus intense et que les zones mortes ont fait disparaitre le plus de poissons.
Rôle encore mal compris de la grande faune marine
Selon [13] l'université Flinders (Australie), le cachalot joue par exemple un rôle important dans le recyclage du fer, via ses excréments qui en contiennent de grandes quantités ; le fer - quand il est biodisponible - est un stimulant connu de la photosynthèse phytoplanctonique, qui est à la base de la pompe à carbone océanique[13]. Les 12.000 cachalots d'Antarctique contribuent ainsi à permettre l'absorption d'environ 400.000 t de carbone (environ deux fois ce que les cachalot émettent en respirant). Leurs excréments dispersent annuellement environ 50 t/an (de fer) dans l'océan, ce serait au moins 10 fois plus, s'ils n'avaient pas été pourchassés depuis deux siècles[13]. Sans la pêche baleinière, on estime qu'il y aurait aujourd'hui environ 120 000 cachalots rien que dans l'océan Antarctique[13].
Améliorer la séquestration naturelle
Forêts
Les forêts sont des réservoirs importants de carbone, par leur biomasse et nécromasse, et via leur sol (certains sols forestier tourbeux d'Indonésie atteignent 40 mètres d'épaisseur). Ce puits de carbone est cependant faible dans certaines forêts, et il n'existe que si elles grandissent ou si leur sol s'enrichit durablement en carbone.
La séquestration forestière est faible au regard des rejets de CO2 liés à la combustion de carbone fossile (charbon, pétrole et gaz naturel). Il y a un consensus sur l'importance de protéger les forêts relictuelles, notamment contre les incendies de forêt, mais même les scénarios les plus optimistes concluent que massivement planter de nouvelles forêts ne suffirait pas à contre-balancer l'augmentation des émissions de gaz à effet de serre ni endiguer le réchauffement climatique. Par exemple, la réduction des émissions américaines de carbone de 7 %, comme stipulé dans le protocole de Kyōto, nécessiterait la plantation d'une forêt de la taille du Texas tous les 30 ans, selon William H. Schlesinger, doyen de "l'école Nicolas sur l'environnement et les sciences de la terre" à l'université Duke de Durham, N.C... Pour compenser leurs émissions, la plupart des régions développées devraient planter une surface bien plus grande que l'ensemble de leur territoire. Il faudrait au total boiser une surface plus grande que celle qui est disponible sur les terres émergées (champs, villes et routes inclus). Néanmoins, le potentiel n'est pas négligeable, surtout si l'on vise des bois durs et denses et l'enrichissement des sols en matière organique, en zone tempérée notamment.
Le type de forêt a une importance : les forêts tempérées sont celles qui poussent le plus vite, mais les forêts tourbeuses plus nordiques forment des puits de carbone également (tourbières). Les forêts tropicales ont d'abord été jugées neutres à l'égard du carbone, mais une étude récente[14] (mesures faites sur 2 millions d'arbres dans le monde) a montré qu'elles étaient globalement aussi des puits de carbone, fonction qui pourrait bientôt être limitée par le stress hydrique.
Le type de gestion importe également : une très jeune forêt plantée sur coupe rase peut avoir un bilan-carbone négatif les 10 ou 12 premières années, perdant plus de carbone qu'elle n'en stocke. La coupe rase favorise en outre souvent l'érosion des sols et la perte du carbone qu'ils contenaient (significative en zone tempérée et froide).Le « réseau forestier de puits CO2 » à long terme est exposé aux incendies, aux tempêtes, aux maladies qui peuvent être exacerbées par un « effet local de refroidissement » dû à l'absorption de carbone lors de la pousse des forêts peut être contre-balancé par les effets de la forêt sur la réflexion de la lumière solaire, ou albédo. Les forêts de haute à moyenne latitude ont un effet albédo plus faible durant les périodes de neige que les forêts enneigées de latitude basse, contribuant au réchauffement climatique. Divers programmes proposent à des entreprises d'acheter des parcelles de forêt pour les protéger (ex action « Cool Earth »), en échange de "crédits-carbone" compensant des émissions industrielles ou de particuliers. Cette approche est discutée. Ainsi en octobre 2007, Davi Kopenawa (chamane amérindien (yanomami) ayant obtenu le prix Global 500 du PNUE en 1991) a remis à Gordon Brown (1er ministre britannique) un rapport montrant que la protection de la forêt par la reconnaissance des droits fonciers de leurs populations autochtones permettrait de protéger rapidement 15 000 fois la surface concernée par le programme « Cool Earth » (162 millions d'ha de forêt tropicale ont déjà ainsi été protégées, par reconnaissance des droits des populations qui y vivent, suite notamment au mouvement lancé par Chico Mendes dans les années 1970)[15]
2008. Selon l'étude de Beverly Law menée sur 519 plots forestiers âgés de l'hémisphère nord, ces arbres anciens ont bien un bilan de capture de CO2 positif.
Séquestration océanique
Article détaillé : fertilisation de l'océan.L'océan est le principal puits de carbone planétaire, mais il est saturé et semble commencer à s'acidifier.
L'ajout de micro-particules de fer (hématite) ou de sulfate de fer dans l'eau a été proposé pour doper la séquestration du carbone par l'océan par le plancton. Le fer naturel est un oligoélément, facteur limitant pour la croissance du phytoplancton. Il provient des remontées d'eau le long de côtes (« upwellings »), des rivières et dépôts d'aérosols et poussières. Certains estiment que les sources naturelles de fer diminuent depuis quelques décennies, limitant la productivité organique et la biomasse océaniques (NASA, 2003) et donc le pompage biologique du CO2 atmosphérique par la photosynthèse.
En 2002, un test dans l'océan Pacifique près de l'Antarctique a suggéré qu'entre 10 000 et 100 000 atomes de carbone sont absorbés lorsque un atome de fer est ajouté dans l'océan. Des travaux allemands (2005) ont laissé penser que tout type de biomasse carbonique des océans, soit enfoui en profondeur, soit recyclé dans la zone euphotique, représente un stockage à long terme du carbone. L'apport de nutriments ferreux dans des zones sélectionnées de l'océan, à juste mesure, pourrait alors doper la productivité océanique et limiter les effets désastreux des émissions humaines de CO2 dans l'atmosphère.
Le Pr Wolfgang Arlt de l'Université d'Erlangen-Nuremberg (Allemagne) propose d'injecter du CO2 dissous à grande profondeur, en veillant à le répartir à l'échelle planétaire et en le tamponnant éventuellement avec des substances alcalines. Il estime que ce CO2 n'aurait qu'un faible impact en termes d'acidification s'il était injecté dans des eaux froides et denses plongeant dans l'océan profond, et que le CO2 ainsi injecté près de l'Europe serait redistribué jusqu'en Australie en un siècle, selon lui sans affecter la vie marine ni la vie des fonds marins.
D'autres doutent de la fiabilité de la méthode, notamment à long terme. Ils argumentent que les effets globaux d'adjonction de fer sur le phytoplancton et sur les écosystèmes océaniques sont mal connus, et nécessitent des études plus poussées.
- Le phytoplancton produit des nuages via la libération de sulfure de diméthyle (DMS) qui est converti en aérosols sulfatés dans l'atmosphère et formant noyau de condensation nuageuse (ou CCN en anglais), l'eau vapeur étant un gaz à effet de serre et les nuages contribuant à modifier l'insolation et donc la photosynthèse.
- Le risque d'eutrophisation et d'acidification doit être localement pris en compte, alors que les zones marines mortes sont plus nombreuses et s'étendent.
- Enfin, ce sont les mers du Sud qui se sont montrées pauvres en fer, alors qu'il ne manque pas dans l'hémisphère Nord, là où les émissions de CO2 sont les plus importantes et où la bioproductivité est la plus élevée.
- Une campagne (KEOPS[16]) a montré[17] autour des îles Kerguelen, zone de floraison estivale annuelle de phytoplancton, que le phénomène était corrélé à la présence de fer venant des eaux profondes, mais que le puits de carbone était au moins deux fois plus important avec le fer naturel que dans le cas d'une fertilisation artificielle, et qu'il fallait bien moins de fer dans le cas de cette « fertilisation » naturelle qui s'est montrée plus de 10 fois plus efficace que les expérimentations d'ensemencement de la mer en fer. Ceci jette le doute sur les propositions d'intervention par l'homme (géo-ingénierie), tout en confirmant l'importance des apports naturels de fer qui pourraient aussi être modifiés par des modifications des courants profonds, ce qui pourrait expliquer certaines fluctuations paléoclimatiques.
L'IPCC reste très prudent sur les capacités de l'océan à absorber plus de carbone, mais juge que l'étude des impacts et du comportement du CO2 dans l'océan profond doit être mieux étudié. L'OMI et la convention de Londres ont estimé fin 2008 que les activités de fertilisation de l'océan autres que pour des expérimentations scientifiques devaient être interdites[18].
Le cycle du méthane dans les écosystèmes et dans les eaux est par ailleurs encore également mal connu.
Sols
On estime que les sols stockaient à la fin du XXe siècle environ 2 000 gigatonnes de carbone sous forme de matière organique. C'est presque trois fois le carbone atmosphérique, et quatre fois le carbone de la biomasse végétale. Mais cette fonction se dégrade rapidement et presque partout, dans les sols agricoles labourés surtout. L'augmentation des quantités d'humus et de matière organique permettraient d'améliorer la qualité de ces sols et la quantité de carbone séquestré. Le semis direct, la vraie jachère la restauration de sols vivant par des techniques de type BRF (Bois raméal fragmenté) peuvent y contribuer.
Le sous-sol stocke deux fois plus que le sol très superficiel.- Les prairies accumulent d'énormes quantités de matières organiques, essentiellement sous forme de racines et micro-organismes, de manière relativement stable sur de longues durées. Mais dans le monde, depuis 1850, une grande partie de ces prairies ont été converties en champs ou urbanisées, perdant ainsi par oxydation de grandes quantités de carbone.
- Une agriculture sans labour augmente le carbone stocké dans le sol, y compris en zone tempérée (testée par exemple à Boigneville en France dans le Bassin parisien où l'on a ainsi obtenu un doublement du stockage annuel de carbone sous une rotation maïs-blé dans le sol les 20 premières années (passant d'environ 0,10 t de C/ha/an à 0,20), après quoi un effet de saturation semble intervenir[19],
- une conversion de champs en pâturage bien gérée emprisonne encore plus de carbone.
- Les mesures de lutte contre l'érosion, le maintien d'une couverture végétale hivernale et une rotation des cultures augmentent aussi le taux de carbone des sols.
L’augmentation du CO2 de l’air pourrait ne pas être compensé par une plus grande séquestration dans les sols. Une étude[20] a montré que l’exposition longue à un doublement du taux de CO2 atmosphérique accélère fortement la dégradation de la matière organique des sols forestiers d’un boisement de chênes (⇒ déstockage de carbone du sol). Les arbres ont stocké plus de carbone (212 g/m² en aérien et 646 g/m² dans les racines), mais 442 g/m² de carbone ont été perdu dans le sol, essentiellement dans les 10 cm superficiels, en raison semble-t-il des impacts du CO2 sur le sol (acidification et stimulation de l'activité enzymatique des microorganismes du sol qui augmente la décomposition de la matière organique, et plus encore s’il y a des apports carbonés (litière)). Cette étude doit être confirmée par des études sur sols riches, car il s’agissait ici de sols pauvres où le carbone était à 75% constitué de chaînes carbonées fragiles.
Séquestration artificielle
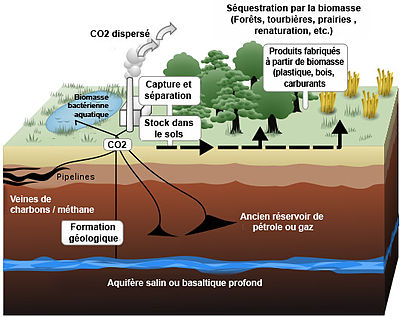 Schéma de principe de la séquestration artificielle du carbone produit par une centrale électrique au fuel, ou de sa valorisation comme engrais (mais acidifiant, et avec un effet de seuil)
Schéma de principe de la séquestration artificielle du carbone produit par une centrale électrique au fuel, ou de sa valorisation comme engrais (mais acidifiant, et avec un effet de seuil) Article détaillé : Stockage géologique du dioxyde de carbone.
Article détaillé : Stockage géologique du dioxyde de carbone.Pour séquestrer du carbone artificiellement (i.e. sans utiliser le processus naturel de cycle de carbone), il doit préalablement être capturé. Ensuite, il est stocké par différents moyens.
Les usines de purification du gaz naturel doivent éliminer le dioxyde de carbone, pour éviter que la glace carbonique obstrue les camions-citernes ou empêcher les concentrations de CO2 d'excéder les 3% maximum permis sur le réseau de distribution de gaz naturel.
Au delà, une des techniques les plus prometteuses d'emprisonnement de carbone est la capture du CO2 provenant des fumées de centrales électriques (dans le cas du charbon, ceci est connu en tant que "charbon propre"). Typiquement, une station électrique récente produisant 1000 mégawatts par combustion du charbon rejette environ 6 millions de tonnes de CO2 annuellement. De plus, une usine de charbon de 1000-MW requiert le stockage de 50 millions de barils de CO2 par an. Les coûts de production de l'électricité sont réduits quand la technologie de gazéification du charbon est utilisée dans les nouvelles installations, bien que cette électricité coûte 10 à 12 % plus cher que celle produite par combustion de carbone fossile.
Le transport du dioxyde de carbone devra répondre à des normes de sécurité sévères, étant donné qu'il est mortel à des concentrations supérieures à 10%, comme l'a montré le tragique dégazage du lac Nyos. La conception de bateaux de transport de dioxyde de carbone sur le même principe que les méthanier est à l'étude.
Capture du carbone
Actuellement, l'absorption du CO2 se fait à grande échelle au moyen de dissolvants aminés, surtout avec le monoéthanolamine (2-aminoéthanol, nomenclature UICPA). D'autres techniques sont à l'étude, comme l'absorption par variation rapide de température/pression, la séparation des gaz et la cryogénie.
Dans les centrales électriques à charbon, les principales alternatives aux absorbeurs de CO2 à base d'amine sont la gazéification du charbon et la combustion oxygène-fuel. La gazéification produit un gaz primaire constitué d'hydrogène et de monoxyde de carbone, qui est brûlé pour donner du dioxyde de carbone. La combustion oxygène-fuel brûle le charbon avec de l'oxygène à la place de l'air, produisant ainsi uniquement du CO2 et de la vapeur d'eau, facilement séparables. Cependant, cette combustion produit une température extrême et les matériaux supportant cette température restent à créer.
Une autre option à long terme est la capture du carbone de l'air en utilisant des hydroxydes. L'air sera littéralement dépouillé de tout son CO2. Cette idée est une alternative aux combustibles non fossiles pour le secteur des transports (voiture, camion, transports en commun…)
Un test mené à l'usine d'électricité de 420 mégawatts de la société Elsam, à Esbjerg (Danemark) a été inauguré le 15 mars 2006[21] dans le cadre du projet européen Castor piloté par l'Institut français du pétrole (IFP) qui rassemble une trentaine de partenaires industriels et scientifiques. Ce procédé postcombustion doit permettre de diviser de moitié le coût de capture du CO2, le ramenant entre 20 et 30 euros la tonne.
Son coût sur quatre ans (2004-2008) est de 16 millions d'euros, dont 8,5 millions sont financés par l'Union européenne. Castor vise à valider des technologies destinées aux grosses unités industrielles - usine électrique, aciérie, cimenterie, etc. -, dont l'activité engendre 10 % des émissions européennes de CO2, afin que cette technique soit en rapport avec le prix européen des permis d'émission de CO2 (alors à 27 € la tonne).
Capture post-combustion
Les rejets de centrales thermiques sont constitués de moins de 20 % de dioxyde de carbone. Ainsi, avant de l'enfouir sous la terre, il faut le capturer: c'est la capture post-combustion. En étant en contact avec des gaz acides (comme le CO2), une solution aqueuse de 2-aminoéthanol forme un sel à température ambiante. La solution est alors transportée dans un milieu fermé où elle est chauffée à environ 120°, ce qui, selon le principe de Le Châtelier, libère le CO2 (pur) et regénère, en solution aqueuse, le 2-aminoéthanol.
Océans
L'injection directe du carbone dans l'océan est un autre type de séquestration envisageable. Dans cette méthode, le CO2 est enfoui dans les eaux profondes, afin de former un « lac » de CO2 liquide piégé par la pression exercée en profondeur. Des expériences menées entre 350 et 3600 mètres indiquent que le CO2 liquide réagit à la pression en se solidifiant en hydrate de méthane, qui se dissout graduellement dans les eaux environnantes. L'emprisonnement n'est donc que temporaire.
Cette technique a des conséquences environnementales dangereuses. Le CO2 réagit avec l'eau pour former de l'acide carbonique H2CO3. L'équilibre biologique des fonds marins, mal connu, sera probablement affecté. Les effets sur les formes de vie benthique des zones pélagiques sont inconnus. D'un point de vue politique, il n'est pas certain que le stockage du carbone dans ou sous les océans soit compatible avec la Convention de Londres sur la prévention de la pollution marine [1].
Une autre méthode de séquestration océanique à long terme est le rassemblement de résidus de récoltes (comme les fanes de blés ou l'excès de paille) dans de grands ballots de biomasse, puis leur dépôt dans les zones "d'éventails alluviaux" (alluvial fan) des bassins océaniques profonds. Immerger ces résidus dans les éventails alluviaux aura pour effet de les enterrer rapidement dans la vase du plancher océanique, emprisonnant la biomasse pour un temps très important. Les éventails alluviaux existent dans tous les océans et mers du monde où les rivières des deltas se jettent dans le plateau continental, comme par exemple pour l'éventail alluvial du Mississippi dans le golfe du Mexique et l'éventail du Nil dans la mer Méditerranée.
Utilisation spécifique d'algues
La ville de Libourne envisage d'équiper un de ses parkings de « lampadaires absorbeurs de CO2 ». Ils se trouveraient munis d'un réservoir contenant des algues. Celles-ci, placées à proximité d'une source de lumière absorberaient le dioxyde de carbone et émettraient du dioxygène[22].
La sélection d'organismes adaptés permet d'envisager d'important rendements. On estime qu'un dispositif de ce type d'un volume d'1,5 m³ pourrait absorber jusqu'à une tonne de CO2 par an.
Sols
Le projet Castor prévoit l'étude de quatre sites de stockage géologique du CO2 : Le réservoir pétrolier de Casablanca qui se situe au large des côtes nord-est de l'Espagne, le gisement de gaz naturel d'Atzbach-Schwanenstadt (Autriche), l'aquifère de Snohvit (Norvège) et le gisement de gaz naturel K12B exploité par Gaz de France au large de la Hollande, desquels il est nécessaire de s'assurer de l'étanchéité. D'autres projets d'esprit similaire sont en cours de par le monde.
Selon le BRGM[23], les 20 milliards de tonnes de dioxyde de carbone émis chaque année devront être stockées dans les aquifères salins. Les aquifères salins sont des nappes d'eau trop salées pour être exploitées. Leur capacité d'accueil est estimée de 400 à 10 000 milliards de tonnes, à comparer aux 40 des gisements de charbons inaccessibles, aux 950 des gisements d'hydrocarbures et aux 20 des émissions annuelles actuelles. Le gaz doit être injecté à une profondeur d'au moins 800 mètres sous 800 bars de pression, à une température de 40 degrés, sous une forme "supercritique" en équilibre avec son environnement. Il formera progressivement de l'eau gazeuse.
Stockage géologique
Article détaillé : Stockage géologique du dioxyde de carbone.Aussi connu sous le nom de séquestration géologique (et plus rarement géoséquestration), cette technique utilise l'injection de dioxyde de carbone directement dans des formations géologiques souterraines. Les champs de pétroles et aquifères salins qui ne sont plus exploités sont des sites de stockages idéals. Les cavernes et anciennes mines, communément utilisés pour stocker le gaz naturel, ne sont pas utilisées à cause d'un manque de sécurité dans le stockage.
Le CO2 a été injecté dans les champs de pétroles en déclin depuis plus de 30 ans, afin d'augmenter le taux de régénération du pétrole. Cette option est intéressante car le coût de stockage est compensé par la vente du pétrole additionnel qui a été régénéré. D'autres bénéfices de cette technique proviennent de l'usage d'infrastructures existantes et des donnés géophysiques et géologiques obtenus par l'exploration du pétrole. Tous les champs de pétrole disposent d'une barrière géologique empêchant la remontée de fluides gazeux (tel le CO2 dans le futur).
Les inconvénients des champs de pétrole résident dans leur distribution géographique et leur capacité limitée.
Puits de carbone et protocole de Kyōto
Le protocole de Kyōto affirmant que la végétation absorbe du CO2, les pays ayant des forêts étendues peuvent en déduire une certaine partie de leurs émissions (article 3, alinéa 3 du protocole de Kyōto); leur facilitant l'accès au niveau d'émission qui leur a été fixé.
On estime qu'en 2030, les combustibles fossiles représenteront encore plus des trois quarts de l'énergie utilisée. Ceux qui sauront piéger le CO2 à sa source (22 % des émissions viennent de l'industrie, 39 % de la production électrique) auront un levier puissant sur le futur marché mondial des quotas d'émissions[21].
Voir aussi
Articles connexes
- Cycle du carbone
- Carbone fossile
- Réchauffement climatique
- Gaz à effet de serre
- Terra preta (sols amazoniens produits par l'homme, à très haute teneur en carbone)
- Tourbière, Bois-mort, humus, Matière organique
- sol, Agriculture sans labour
- Field-Map - technologie pour le suivi des stocks de carbone
Documentaires
Bibliographie
- [24]
- APPS M.-J (2003). Les forêts, le cycle mondial du carbone et le changement climatique. Actes du XIIe Congrès forestier mondial, Québec city, Canada, 2003. (consulté le 08/10/2007).
- DUPOUEY Jean-Luc, PIGNARD Gérôme (2001). Quelques problèmes posés par l’évaluation des flux de carbone forestier au niveau national. Revue Forestière Française, n° spécial "les 40 ans de l’IFN", 3-4-2001
- DUPOUEY Jean-Luc, PIGNARD Gérôme, HAMZA Nabila (2006). INRA – La séquestration de carbone en forêt ; consulté le 05/10/2007.
- EurObserv’ER (2006). Le baromètre biomasse solide. Systèmes solaires n°176, décembre 2006 (consulté le 25/10/2007).
- IFN (Inventaire Forestier National) (2005). L’IF n°7 – La forêt française : un puits de carbone ? Son rôle dans la limitation des changements climatiques PDF en ligne. L’IF, mars 2005.
- Ministère de l'Écologie, du Développement et de l’Aménagement Durables (2006). Qu’est-ce qu’un projet domestique CO2 ? ; Décembre 2006.
- PIGNARD Gérôme (2000). Évolution récente des forêts françaises : surface, volume sur pied, productivité. Revue Forestière Française, Tome LII, n° spécial 2000, p. 27-36.
- PIGNARD Gérôme, HAMZA Nabila, DUPOUEY Jean-Luc (2004). Estimation des stocks et des flux de carbone dans la biomasse des forêts françaises à partir des données de l’Inventaire forestier national, In LOUSTAU Denis (coord.). Rapport final du projet CARBOFOR : Séquestration de Carbone dans les grands écosystèmes forestiers en France. Quantification, spatialisation, vulnérabilité et impacts de différents scénarios climatiques et sylvicoles. Juin 2004.
Liens externes
- (fr) Note de Manicore sur la capacité des puits de carbone à absorber ou non le surplus de CO2
- (fr) Pour voir l'évolution des puits de carbone de 1850 à nos jours, animation Flash
Références
- Voir Article 83 de la Loi Grenelle II, page 115/308 de la version PDF
- Giec, Changements climatiques 2001 : Rapport de synthèse. Résumé à l’intention des décideurs, 2001, 37 p.
- voir carte mondiale, in Joël Boulier, Géographie et environnement ; Les forêts au secours de la planète : quel potentiel de stockage du carbone ? ; L'Espace géographique 2010/4 (Tome 39), 98 pages, Ed : Belin ; ISBN:9782701156217 (Résumé)
- (en) The case of the missing sink
- Évaluation des ressources forestières mondiales 2010 ; Rapport principal, évaluation la plus complète jamais faite des forêts mondiales jamais effectuée, pour 233 pays et zones et pour la période 1990 à 2010 et pour pour plus de 90 variables clés relatives à l’étendue, l’état, les utilisations et les valeurs des forêts.. Version francophone, FAO, 2010
- IFN, La forêt française : un puits de carbone ? son rôle dans la limitation des changements climatiques, l'IF, 7 mars 2005
- L’environnement en France - Édition 2010 - COll. Références Commissariat général au développement durable, juin 2010 par le service de l'observation et des statistiques
- Anthropogenic CO2 Uptake by the Ocean Based on the Global Chlorofluorocarbon, McNeil et al. Science 10 Janvier 2003: 235 DOI: 10.1126/science.1077429 ((résumé, en anglais)
- Deep-sea Research, Par II, Colloque SOCOVV, Unesco/IOCCP, 8 février 2009
- R. W. Wilson,1; F. J. Millero; J. R. Taylor ; P. J. Walsh ; V. Christensen ; S. Jennings,;M. Grosell; « Contribution of Fish to the Marine Inorganic Carbon Cycle »; Science 16 January 2009: Vol. 323. no. 5912, pp. 359 - 362 DOI: 10.1126/science.1157972 ; 2009
- ...si on estime qu'il y a 812 millions de t de poissons dans les mers (fourchette basse)
- ...si l'on estime qu'il y a 2,05 milliards de tonnes(fourchette haute crédible)
- Trish J. Lavery, Ben Roudnew, Peter Gill, Justin Seymour1, Laurent Seuront, Genevieve Johnson, James G. Mitchell1 and Victor Smetacek ; Iron defecation by sperm whales stimulates carbon export in the Southern Ocean ; journal de recherche biologique de la Royal Society: Proceedings of the Royal Society, Biological Sciences ; Online ISSN:1471-2954 ([résumé])
- Chave J, Condit R, Muller-Landau HC, Thomas SC, Ashton PS, et al. (2008) Assessing Evidence for a Pervasive Alteration in Tropical Tree Communities. PLoS Biol 6(3): e45
- Source : Courrier international du 24 nov 2007, et Survival International
- Kerguelen Ocean and Plateau compared Study, associant 16 laboratoires de recherche dans le monde (français, australien, belge et néerlandais)
- Effect of natural iron fertilization on carbon sequestration in the Southern Ocean. Stéphane Blain et al. Nature. 26 avril 2007.
- Communiqué de la Convention de Londres et de l'OMI intitulé "Ocean fertilization operations should be allowed only for research, say Parties to international treaties"
- A Metay, B Mary, D Arrouays, J Labreuche, M Martin, B Nicolardot, J -C Germon Effets des techniques culturales sans labour sur le stockage de carbone dans le sol en contexte climatique tempéré ; Canadian Journal of Soil Science, 2009, 89:(5) 623-634, 10.4141/CJSS07108 (Résumé)
- Expérience faite par le Smithsonian Environmental Research Center, dans le Merritt Island Wildlife Refuge, (Cape Canaveral, Floride) sur des chênes de Turquie (Quercus laevis) poussant sur sols pauvres et exposés 6 ans à un doublement du taux de CO2. Source : Karen M. Carney, Bruce A. Hungate, Bert G. Drake, and J. Patrick Megonigal, Altered soil microbial community at elevated CO2 leads to loss of soil carbon, Proc. Natl. Acad. Scie. U.S.A., published March 13, 2007, 10.1073/pnas.0610045104 texte intégral)
- Le Monde du 19 mars 2006
- Archives du Monde lampadaires à algues-absorbeurs de CO2 de Libourne, proposés par la sté Tyca
- Cité par Libération, 3 juin 2006, page 37
- Arrouays D & al. Estimation de stocks de carbone organique des sols à différentes échelles d’espace et de temps, Reçu: mai 2003; Accepté: novembre 2003 Étude et Gestion des Sols, Volume 10, 4, 2003 - pages 347 à 355
Wikimedia Foundation. 2010.


![Stock de carbone dans le monde (hors océans), selon le GIEC (2001[2])](/pictures/frwiki/50/280px-Stock_carbone_mondial.jpg)