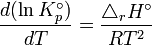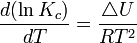Relation de van 't Hoff
- Relation de van 't Hoff
-
Relation de Van't Hoff
La relation de Van't Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d'équilibre d'une réaction chimique à l'énergie mise en jeu lors de cette réaction : enthalpie dans les cas isobares et énergie interne dans les cas isochores. Elle tire son nom du chimiste et physicien néerlandais Jacobus Henricus van 't Hoff.
Relation isobare
On donne le nom d'isobare de Van't Hoff à la formule suivante :
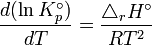
Relation isochore
On donne le nom d'isochore de Van't Hoff à la formule suivante :
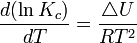
 Portail de la chimie
Portail de la chimie Portail de la physique
Portail de la physique
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Relation de van 't Hoff de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Relation de Van't Hoff — La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction : enthalpie dans les cas… … Wikipédia en Français
Relation Isobare de Van't Hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Relation Isochore de Van't Hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Relation isobare de van't hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Relation isochore de van't hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Isobare de Van't Hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Isochore de Van't Hoff — Relation de Van t Hoff La relation de Van t Hoff est une équation thermodynamique reliant la variation en fonction de la température de la constante d équilibre d une réaction chimique à l énergie mise en jeu lors de cette réaction :… … Wikipédia en Français
Loi de Van't Hoff — Déplacement d équilibre Dans de nombreuses synthèses chimiques, l un des principaux buts est d améliorer le rendement. Lorsque ces synthèses sont des équilibres, comme par exemple dans le cadre de l estérification, on cherche à déplacer ces… … Wikipédia en Français
Loi de van 't Hoff — Déplacement d équilibre Dans de nombreuses synthèses chimiques, l un des principaux buts est d améliorer le rendement. Lorsque ces synthèses sont des équilibres, comme par exemple dans le cadre de l estérification, on cherche à déplacer ces… … Wikipédia en Français
Van 't Hoff factor — In physical chemistry, the van t Hoff factor i is the number of moles of solute actually in solution per mole of solid solute added. Equivalently, i refers to the ratio of true molecular mass to calculated molecular methods by colligative methods … Wikipedia
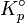 Constante d'équilibre relative aux pressions partielles.
Constante d'équilibre relative aux pressions partielles.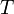 Température.
Température.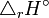 Enthalpie de réaction standard.
Enthalpie de réaction standard.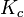 Constante d'équilibre relative aux concentrations molaires.
Constante d'équilibre relative aux concentrations molaires.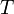 Température.
Température.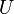 Énergie interne.
Énergie interne.