- Substitution nucléophile bimoléculaire
-
SN2
La substitution nucléophile bimoléculaire, ou communément appelée SN2 est un mécanisme réactionnel en chimie organique. C'est en fait un mécanisme limite, au sens où des réactions chimiques « naturelles » usant de ce type de mécanisme ne se font jamais entièrement selon ce mécanisme, mais à un certain pourcentage. Le mécanisme limite « opposé » est la substitution nucléophile monomoléculaire ou SN1.Sommaire
Cinétique de la réaction
La réaction de substitution nucléophile bimoléculaire est appelée ainsi car il s'agit d'une réaction en 1 étape, où 2 réactifs réagissent; elle a donc une cinétique de second ordre. L'expression de sa vitesse de réaction est donc la suivante :
![v = k \left[ \mathrm{RX} \right] \left[ Nu \right]](/pictures/frwiki/98/b76f771ca1f5bd308d4ba18dcfdc5099.png)
Cette expression de la vitesse reste juste tant que le composé nucléophile reste dans des concentrations raisonnables. Si ce dernier est le solvant, on observe un comportement de pseudo premier ordre cinétique, c’est-à-dire une vitesse exprimée de la façon suivante :
![v^{\prime} = k^{\prime} \left[ \mathrm{RX} \right]](/pictures/frwiki/56/8a7619558ec9122a1ef14568e1f93eed.png)
Mécanisme réactionnel
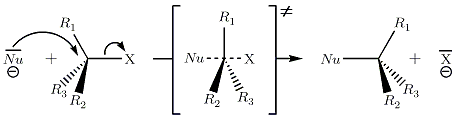
Figure : les trois liaisons autour du carbone central sont coplanaires dans l'ET≠.
La substitution nucléophile bimoléculaire, ou SN2 est une réaction se faisant en une seule étape, sans intermédiaire réactionnel. L'atome X est plus électronégatif que le carbone auquel il est lié. Il capte les électrons de la liaison et dans un même temps, un groupe nucléophile — noté Nu — se lie au carbone, de l'autre coté du carbone central. On peut alors observer une inversion de la stéréochimie relative du carbone central, mais une conservation de la configuration absolue. C'est cette particularité qui fait de la réaction SN2 une réaction stéréospécifique. L'inversion citée précédemment est nommée « inversion de Walden ». Le postulat de Hammond permet de définir un état de transition — ET≠.Stéréochimie
La réaction de substitution nucléophile bimoléculaire, a contrario de la SN1, est à la fois stéréosélective, stéréospécifique et même énantièrospécifique. Puisque la configuration absolue est conservée par la réaction, un composé de configuration rectus (R) ou sinister (S) donnera respectivement un composé sinister ou rectus par la réaction de SN2. Il en va de même pour les couples de composés, tels que les énantiomères, ou les diastéréoisomères, par exemple :
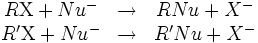
Si les composés RX et
 ont une stéréochimie particulière, leurs produits par SN2 ont la même stéréochimie.
ont une stéréochimie particulière, leurs produits par SN2 ont la même stéréochimie.Influence de certains facteurs
Influence du nucléofuge
Deux facteurs doivent être pris en considération, la nucléophilie et la polarisabilité du nucléofuge (à noter que ces deux facteurs sont typiquement en corrélation : un bon nucléophile présente en général une polarisabilité élevée, puisque la déformation du nuage électronique est un des processus-clé de l'établissement de la nouvelle liaison chimique). L'électronégativité du nucléofuge est importante dans la mesure où elle détermine partiellement le caractère polaire du lien chimique R-X, lequel rend le substrat vulnérable aux attaques nucléophiles. Ainsi, on retrouvera les meilleurs nucléofuges à droite du tableau périodique (halogènes).
Ceci dit, plus le nucléofuge sera polarisable, plus la réaction sera rapide[1]. Lorsqu'un nucléophile anionique s'approche de la "molécule cible", il y induira un dipôle plus aisément si le nucléofuge est polarisable. Typiquement, la polarisabilité d'un atome est corrélée avec le rayon de son nuage électronique. La taille d'un atome augmente au fur et à mesure que l'on descend dans une colonne du tableau périodique.
Parmi les halogènes, on peut classer la nucléofugacité comme ceci :
I > Br > Cl > F Ainsi, l'iode est un meilleur nucléofuge que le chlore grâce à sa plus grande polarisabilité. De même l'ordre de nucléophilie est en général identique.[2]
I > Br > Cl > F Influence du nucléophile
De manière simple et évidente, plus le nucléophile — Nu — sera polarisable, et plus la SN2 sera rapide et favorisée, cinétiquement parlant.
Influence du solvant
De façon similaire à l'influence du nucléophile, un solvant polaire stabiliserait le composé nucléophile, c'est pourquoi la SN2 sera favorisée dans un solvant peu polaire et aprotique — solvant ne créant pas de liaisons hydrogène.
Influence du groupement alkyle
On observe des réactivités et des vitesses différentes suivant la classe du réactif. En effet, la possibilité de l'inversion de Walden, développée précédemment, est tributaire de la gène stérique provoquée par les chaines liées au carbone central. On introduit donc les classes suivantes de composés :
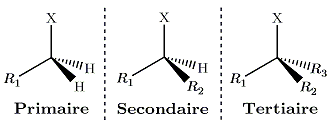
La SN2 sera favorisée pour un réactif primaire. Et fortement défavorisée pour un composé tertiaire : en effet les chaines R1, R2 et R3 proposent une gêne importante du côté d'attaque du nucléophile, l'état de transition est haut en énergie et peut être impossible à atteindre, les produits ne peuvent alors pas se former. On ne peut pas statuer a priori sur le sort du composé secondaire, la réaction pouvant ou non se produire selon les conditions expérimentales.
Exemple de SN2
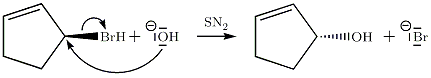
Cet exemple montre que le produit d'une molécule chirale par une SN2 est une molécule chirale.
Voir aussi
- Substitution nucléophile
- SN1 : Substitution nucléophile monomoléculaire
- Chimie Organique
Références
- Portail de la chimie
Catégorie : Réaction de substitution
Wikimedia Foundation. 2010.
