- Élément de transition
-
Métal de transition
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No On appelle métal de transition un élément chimique du bloc d du tableau périodique qui n'est ni un lanthanide ni un actinide. Il s'agit des 38 éléments des périodes 4 à 7 et des groupes 3 à 12 hormis le lutécium 71Lu (un lanthanide) et le lawrencium 103Lr (un actinide).
Il existe en fait plusieurs définitions possibles des métaux de transitions, qui conduisent à délimiter de façon différente l'ensemble des éléments concernés :
- On confond parfois les métaux de transitions avec les éléments du bloc d, ce qui conduit à inclure le lutécium et le lawrencium ; cette définition est assez logique mais l'UICPA définit expressément ces éléments respectivement comme un lanthanide et un actinide, ce qui les exclut du champ des métaux de transition.
- L'UICPA définit les métaux de transition comme les éléments qui ont une sous-couche d incomplète ou qui peuvent donner un cation ayant une sous-couche d incomplète. Cette définition revient à exclure les éléments du groupe 12 (zinc, cadmium, mercure et copernicium), qui ont une sous-couche d complète[1], et pose un problème pour le lutécium et le lawrencium, qui se retrouvent ainsi affectés à deux séries chacun.
La liste la plus large des métaux de transition peut donc être résumée par le tableau suivant :
Sommaire
Configuration électronique
Les métaux de transition sont des éléments du bloc d, qui remplissent progressivement une sous-couche électronique d en dessous d'une sous-couche s saturée, conformément à la règle de Klechkowski. Cette règle permet d'expliquer la configuration électronique d'un peu plus de 80 % des éléments chimiques ; les quelque 20 % restants se trouvent précisément parmi les métaux de transition, les lanthanides, et les actinides : c'est le cas des deux premiers éléments du groupe 6 et de tous ceux du groupe 11, pour lesquels une configuration de type s1 d5 ou s1 d10 est énergétiquement plus favorable que la configuration de type s2 d4 ou s2 d9 qu'on attendrait en appliquant la règle de Klechkowski ; cette configuration particulière est également observée pour certains éléments adjacents aux groupes 6 et 11 ; la configuration électronique exacte à l'état fondamental des métaux de transition de la septième période (transactinides) reste trop mal connue pour y caractériser de telles exceptions :
-
Élément chimique Configuration électronique no 21 Sc Scandium 1s2 2s2 2p6 3s2 3p6 4s2 3d1 no 22 Ti Titane 1s2 2s2 2p6 3s2 3p6 4s2 3d2 no 23 V Vanadium 1s2 2s2 2p6 3s2 3p6 4s2 3d3 no 24 Cr Chrome 1s2 2s2 2p6 3s2 3p6 4s1 3d5 ( * ) no 25 Mn Manganèse 1s2 2s2 2p6 3s2 3p6 4s2 3d5 no 26 Fe Fer 1s2 2s2 2p6 3s2 3p6 4s2 3d6 no 27 Co Cobalt 1s2 2s2 2p6 3s2 3p6 4s2 3d7 no 28 Ni Nickel 1s2 2s2 2p6 3s2 3p6 4s2 3d8 no 29 Cu Cuivre 1s2 2s2 2p6 3s2 3p6 4s1 3d10 ( * ) no 30 Zn Zinc 1s2 2s2 2p6 3s2 3p6 4s2 3d10 no 39 Y Yttrium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 no 40 Zr Zirconium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 no 41 Nb Niobium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 ( * ) no 42 Mo Molybdène 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 ( * ) no 43 Tc Technetium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 no 44 Ru Ruthénium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 ( * ) no 45 Rh Rhodium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 ( * ) no 46 Pd Palladium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 ( * ) no 47 Ag Argent 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 ( * ) no 48 Cd Cadmium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 no 72 Hf Hafnium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 no 73 Ta Tantale 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d3 no 74 W Tungstène 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 no 75 Re Rhénium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d5 no 76 Os Osmium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6 no 77 Ir Iridium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7 no 78 Pt Platine 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9 ( * ) no 79 Au Or 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10 ( * ) no 80 Hg Mercure 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 no 104 Rf Rutherfordium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d2 ? no 105 Db Dubnium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d3 ? no 106 Sg Seaborgium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d4 ? no 107 Bh Bohrium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d5 ? no 108 Hs Hassium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d6 ? no 109 Mt Meitnérium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d7 ? no 110 Ds Darmstadtium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d8 ? no 111 Rg Roentgenium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d9 ? no 112 Cn Copernicium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 ?
- ( * ) Exceptions à la règle de Klechkowski :
-
- Période no 4 : chrome 24Cr, cuivre 29Cu,
- Période no 5 : niobium 41Nb, molybdène 42Mo, ruthénium 44Ru, rhodium 45Rh, palladium 46Pd, argent 47Ag,
- Période no 6 : platine 78Pt, or 79Au.
-
États d'oxydation
Contrairement aux deux premiers groupes du tableau périodique (les métaux alcalins et les métaux alcalino-terreux), les métaux de transition (notamment des groupes 4 à 11) peuvent former des ions avec une grande variété d'états d'oxydation. Les métaux alcalino-terreux tels que le calcium sont stables à l'état d'oxydation +2, alors qu'un métal de transition peut adopter des degrés d'oxydation de -3 à +8. On peut en comprendre la raison en étudiant les potentiels d'ionisation des éléments deux séries. L'énergie requise pour enlever un électron du calcium est faible jusqu'à ce qu'on commence à enlever des électrons sous les deux électrons de sa sous-couche 4s. En fait, Ca3+ a une telle énergie d'ionisation qu'il n'existe pas naturellement. En revanche, avec un élément comme le vanadium, on observe une augmentation linéaire de l'énergie d'ionisation entre les orbitales s et d, ceci étant dû à la très faible différence énergétique entre les sous-couches 3d et 4s. Ainsi, un élément comme le manganèse, avec une configuration [Ar] 4s2 3d5, peut perdre sept électrons et atteindre l'état d'oxydation +7, tandis que le ruthénium et l'osmium atteignent couramment l'état d'oxydation +8 :
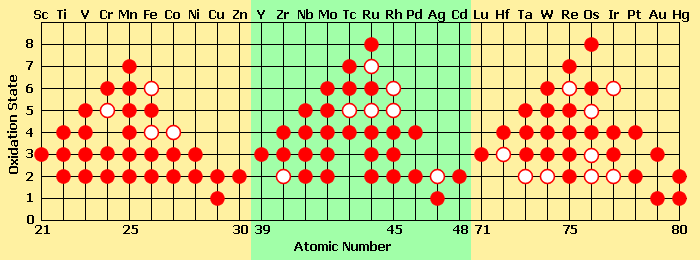 États d'oxydation des métaux de transition : un disque plein représente un état d'oxydation courant, un cercle vide indique un état d'oxydation plus rare — énergétiquement moins favorable.
États d'oxydation des métaux de transition : un disque plein représente un état d'oxydation courant, un cercle vide indique un état d'oxydation plus rare — énergétiquement moins favorable.Certaines tendances dans les propriétés des métaux de transition peuvent être observées le long d'une période :
- Le nombre d'états d'oxydation de chaque ion augmente jusqu'au groupe 7 ou 8, puis diminue.
- Un élément dans un faible état d'oxydation peut se trouver sous forme d'ion simple, mais, pour les états d'oxydation les plus élevés, généralement sous forme d'un composé covalent d'oxygène ou de fluor.
Couleurs des complexes de métaux de transition
 De gauche à droite :
De gauche à droite :
- Nitrate de cobalt(II) Co(NO3)2 (rouge)
- Dichromate de potassium K2Cr2O7 (orange)
- Chromate de potassium K2CrO4 (jaune)
- Chlorure de nickel(II) NiCl2 (vert)
- Sulfate de cuivre(II) CuSO4 (bleu)
- Permanganate de potassium KMnO4 (violet)Compte tenu de leur grande variété d'états d'oxydation et donc de configurations électroniques, les métaux de transition forment des composés aux couleurs les plus variées. Tout le spectre visible est couvert, la couleur d'un élément donné dépendant aussi de son état d'oxydation : ainsi le manganèse à l'état d'oxydation +7 est violet (permanganate de potassium) tandis que l'ion Mn2+ est rose pâle.
La coordination d'un ligand est susceptible de modifier les niveaux d'énergie des orbitales d et donc la couleur des composés d'un métal de transition donné.
Les facteurs déterminant la couleur d'un complexe sont :
- la nature de l'ion métallique, en particulier le nombre d'électrons de l'orbitale d dans la couche de valence
- la nature des ligands autour de l'ion métallique, ce qui conditionne l'effet sur les niveaux d'énergie des orbitales d
- la géométrie de ces ligands autour de l'ion métallique, car des diastéréoisomères peuvent avoir des couleurs différentes.
Propriétés
Les métaux de transition ont en général une densité ainsi qu'une température de fusion et de vaporisation élevées, sauf ceux du groupe 12, qui ont au contraire un point de fusion assez bas : le mercure est ainsi liquide au-dessus de -38,8 °C et le copernicium serait peut-être même gazeux à température ambiante. Ces propriétés proviennent de la capacité des électrons de la sous-couche d à se délocaliser dans le réseau métallique. Dans les substances métalliques, plus le nombre d'électrons partagés entre les noyaux est grand, plus grande est la cohésion du métal.
Certains métaux de transition forment de bons catalyseurs homogènes et hétérogènes. Par exemple, le fer est un catalyseur dans le procédé Haber, le nickel et le platine sont utilisés dans l'hydrogénation des alcènes.
Le groupe du platine constitue un ensemble important de métaux de transitions aux propriétés remarquables, qui en font d'excellents catalyseurs aux applications stratégiques.
Notes et références
- ↑ Ces éléments ne forment que de rares composés, de surcroît instables, avec une sous-couche d incomplète, et le mercure(I) ne se présente que sous la forme du dication Hg22+, ce qui n'est justement pas un cation ayant une sous-couche d incomplète.
Liens externes
- UICPA : Page de liens vers le tableau périodique
- UICPA : Tableau périodique officiel du 22/06/2007
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégorie : Métal de transition
Wikimedia Foundation. 2010.
