- Éthanol
-
Éthanol 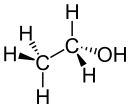
Molécule d'éthanolGénéral Nom IUPAC Éthanol Synonymes alcool éthylique
EtOHNo CAS No EINECS Code ATC AE06, D08, AB16, AZ01 DrugBank PubChem ChEBI No E E1510 FEMA SMILES InChI Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C2H6O [Isomères] Masse molaire[3] 46,0684 ± 0,0023 g·mol-1
C 52,14 %, H 13,13 %, O 34,73 %,Moment dipolaire 1,66 D [2] Diamètre moléculaire 0,469 nm [2] Propriétés physiques T° fusion -117 °C[1] T° ébullition 79 °C[1] Solubilité dans l'eau : miscible[1],
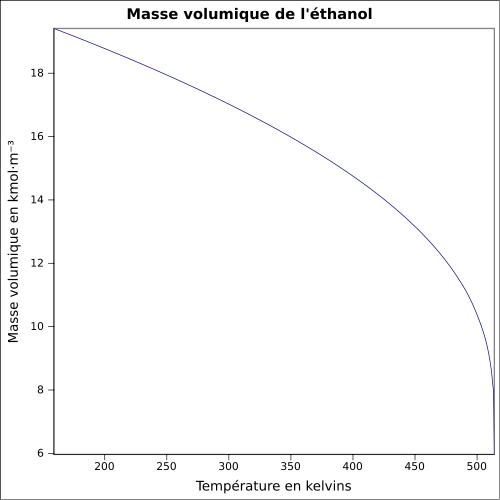
Complète dans les solvants polaires et apolaires (acétone, éther diéthylique)Masse volumique  0,789 [4]
0,789 [4]
T° d'auto-inflammation 423 à 425 °C;
363 °C (selon les sources)[4]Point d’éclair coupelle fermée :
13 °C pur
17 °C 95 %vol.
21 °C 70 %vol.
49 °C 10 %vol.
62 °C 5 %vol[4].Limites d’explosivité dans l’air Inférieure : 3,5 %vol [6]
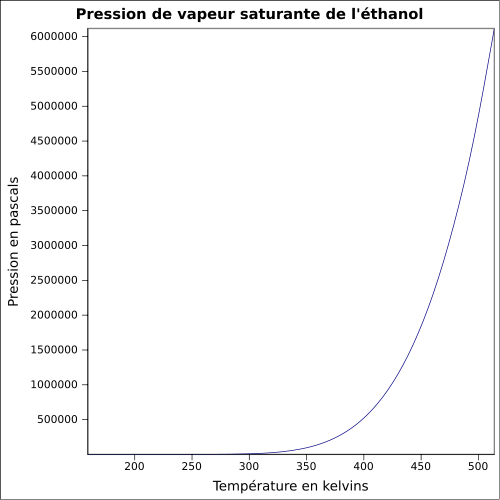
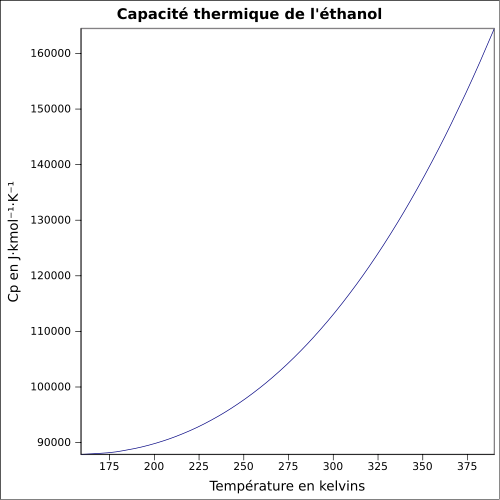
Supérieure : 15 %vol [6]Pression de vapeur saturante à 20 °C : 5,8 kPa[1] Viscosité dynamique 1,20 10-3 Pa·s à 20 °C Point critique 240,85 °C, 6,14 MPa, 0,168 l·mol-1[7] Vitesse du son 1 162 m·s-1 à 20 °C [8] Thermochimie S0liquide, 1 bar 159,86 J/mol·K[9] ΔfH0gaz − 235,3 kJ/mol ΔfH0liquide − 277,0 kJ/mol[10] Cp 111 J·K-1·mol-1 Propriétés électroniques 1re énergie d'ionisation 10,43 ± 0,05 eV (gaz)[12] Cristallographie Classe cristalline ou groupe d’espace Pc [13] Paramètres de maille a = 5,377 Å
b = 6,882 Å
Z = 4 [13]
c = 8,255 Å
α = 90,00 °
β = 102,20 °
γ = 90,00 °Volume 298,57 Å3 [13] Densité théorique 1,025 [13] Propriétés optiques Indice de réfraction  1,3594 [2]
1,3594 [2]Précautions Directive 67/548/EEC[15] 
FPhrases R : 11, Phrases S : 2, 7, 16, Transport 33 1170 NFPA 704 SGH[16],[17] 
DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[14] Inhalation ébriété, nausée, vomissements Peau aucun effet Yeux dangereux Ingestion ébriété, nausée, vomissements, coma éthylique (pouvant entraîner la mort) Écotoxicologie DL50 5 à 20 g·kg-1[4] CL50 20 000 à 30 000 ppm pendant 4 à 6 heures[4] LogP -0,32[1] Seuil de l’odorat bas : 49 ppm
haut : 716 ppm[18]Données pharmacocinétiques Métabolisme au niveau du foie en aldéhyde acétique puis acide acétique, à ~100 mg·kg-1 par heure[4] Unités du SI & CNTP, sauf indication contraire. L’éthanol, ou alcool éthylique, est un alcool primaire, possédant la structure semi-développée suivante : CH3-CH2-OH. En chimie, l’éthanol est usuellement désigné par l’abréviation EtOH. C’est un liquide incolore, miscible à l'eau en toutes proportions.
Dans la vie courante, il est souvent simplement appelé « alcool », car l'éthanol est l'alcool qui se retrouve dans toutes les boissons alcoolisées. Dans la pharmacopée européenne, "éthanol" désigne l’éthanol absolu, c'est-à-dire pur à 100 % (sans eau), en opposition à l'éthanol à 95 % ou 70 % que l'on trouve en pharmacie. À cela, s'ajoute la qualité "alcool Ph. Eur." (Pharmacopée européenne) qui désigne une qualité d'éthanol dont on a quantifié de nombreuses traces et impuretés. La norme Pr Eur autorise un certain pourcentage d'eau (4 %). Ses synonymes sont esprit de vin, alcool de grain. L'alcoolisme est la consommation excessive de boissons contenant de l'éthanol.
Historiquement, l'éthanol a été produit par fermentation directe de sucres naturels : la production de vin ou de bière fermentée est attestée dans l'empire babylonien dès 3000 av. J.-C. Les premières obtentions pures sont probablement[évasif] dues aux alchimistes perses [réf. nécessaire] qui développèrent l'art de la distillation au VIIIe et IXe siècle de l'ère chrétienne.
On le fabrique aussi industriellement par hydratation de l'éthylène.
L'éthanol est utilisé comme intermédiaire de synthèse dans l'industrie chimique et comme solvant. C'est aussi un désinfectant. Il a été utilisé pour la conservation de la viande.
En Amérique du Sud et surtout au Brésil, certaines essences disponibles à la pompe peuvent comporter jusqu'à 20 % d'éthanol et portent le nom d’ethanol blend.
En France, le gouvernement a lancé officiellement fin 2006 l'E85, un mélange de 85 % d'éthanol et de 15 % d'essence comme biocarburant. Il est disponible dans plusieurs centaines de stations-service depuis la fin de l'année 2007. Un mélange E10 avec 10 % d'éthanol est disponible depuis avril 2009.
Sommaire
Propriétés physiologiques
La prise de boissons alcoolisées entraine différents effets. Cela peut créer une dépendance ce qui classe l'éthanol dans les drogues. Celle-ci serait la plus nocive des drogues pour les sociétés[19].
Article détaillé : boisson alcoolisée#Physiologie.Mécanismes neurologiques
L'éthanol interagit avec différents types de récepteurs dans les synapses : récepteurs au GABA, à la sérotonine,l'acétylcholine, au glutamate, récepteur NMDA[20].
Utilisation médicale
L'éthanol absolu est parfois injecté dans des tumeurs afin de provoquer leur nécrose. Il n'a toutefois pas une activité ciblée puisqu'il provoque indifféremment la nécrose des tissus sains et cancéreux.
L'éthanol est aussi utilisé comme antidote dans le cas d'intoxication au méthanol ou à l'éthylène glycol (antigel), afin de saturer l'ADH (alcool déshydrogenase)
Production et synthèse
Par hydratation catalytique directe de l'éthylène
La synthèse de l'éthanol par hydratation de l'éthylène repose sur la réaction suivante :

La variation d'enthalpie liée à cette réaction est ΔRH = − 43,4 kJ·mol−1[21]. Pour obtenir un rendement à l'équilibre satisfaisant (usuellement compris entre 7 % et 22 %), cette réaction nécessite d'être catalysée. La majorité des catalyseurs décrits dans la littérature technique présentent un caractère acide. On citera notamment l'acide phosphorique et l'acide silicotungstique. Ces catalyseurs imprègnent généralement un support poreux.
Le produit final de l'hydratation de l'éthylène est un mélange contenant entre 10 % et 25 % d'éthanol en poids. Des distillations successives seront donc nécessaires pour obtenir un mélange plus concentré. Au final, les conditions optimales pour la réalisation de cette réaction d'hydratation dépendent grandement du catalyseur utilisé, des caractéristiques du réacteur et des qualités du produit de départ.
Par hydratation indirecte de l'éthylène
La production d'éthanol par hydratation indirecte de l'éthylène fait intervenir un mécanisme réactionnel plus complexe avec deux grandes étapes : un ensemble de réactions d'estérification puis d'hydrolyse. Ce procédé consomme de grandes quantités d'acide sulfurique et nécessite en entrée un mélange gazeux de bonne qualité.
Production d'éthanol à partir de la biomasse
Dans ce cas, on parle de bioéthanol. La majorité du bioéthanol produit aujourd'hui provient du traitement des plantes sucrières (betterave, canne à sucre, …) ou des céréales (maïs, blé, …). La production de bioéthanol à partir de la biomasse se divise sommairement en trois étapes.
- L'hydrolyse de la céréale : contrairement aux plantes sucrières qui donnent du sucre directement, il est nécessaire d'hydrolyser l'amidon (polymère du glucose) contenu dans les céréales afin d'obtenir du glucose. Cette hydrolyse peut se faire par des enzymes (hydrolyse enzymatique) ou par de l'acide (hydrolyse acide, nécessite que le mélange soit porté à ébullition).
- La fermentation du glucose : on utilise pour cette étape des levures que l'on insère dans un mélange de sucre et d'eau. La durée de fermentation varie mais tourne aux alentours de quelques semaines. A l'issue de cette étape on obtient un éthanol très dilué, inutilisable pour l'instant.
- La distillation : pour extraire l'éthanol du mélange d'éthanol et d'eau on peut procéder à une distillation fractionnée. Cette distillation s'appuie sur la température d'ébullition de l'éthanol, inférieure à celle de l'eau. Le mélange appelé parfois alcoolat est porté à ébullition, et l'éthanol s'évapore avant que l'eau ne commence à bouillir. En pratique, une certaine proportion d'eau et de produits plus volatiles que l'éthanol entrent dans le liquide obtenu après la première distillation qu'on appelle parfois flegme, la flegmasse étant le résidu de cette distillation. D'autre part, de multiples distillations ne permettent pas d'obtenir un éthanol à plus de 96 % car il forme avec l'eau un azéotrope (96 %, PE:78,17 °C[22]). Pour obtenir de l'éthanol plus pur, il faut déshydrater l'azéotrope, par exemple en le distillant sur CaO. Si le point azéotropique est dépassé, les distillations sont de nouveau opérationnelles.
D'autres filières existent cependant, notamment la production de bioéthanol (dit bioéthanol cellulosique) à partir de déchets végétaux (sciure de bois, paille de blé, emballages, …). En effet ces produits contiennent de grandes quantités de cellulose, un autre polymère du glucose. Le problème réside dans l'hydrolyse de la cellulose, difficilement réalisée à ce jour. Le procédé le plus élaboré dans ce domaine est actuellement celui développé par l'entreprise canadienne Iogen Corporation.
Propriétés physico-chimiques
L'eau en faible proportion forme un azéotrope avec l'éthanol et au-delà de 96 % de pureté en EtOH, il devient très difficile de les séparer. Les proportions du mélange varient en fonction de la température et de la pression[23].
pression température fraction molaire d'éthanol 0,1 MPa 78,35 °C 0,894 0,344 MPa 112,6 °C 0,882 0,689 MPa 135,7 °C 0,874 1,378 MPa 164,2 °C 0,862 2,068 MPa 182,6 °C 0,852 Notes et références
- ETHANOL (ANHYDRE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 978-0-471-98369-9) (LCCN 98018212)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Fiche toxicologique FT 48 de l'Institut national de recherche et de sécurité (INRS), publiée en 2007
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 978-0-07-049841-9) (LCCN 96051648), p. 2-50
- Kohn-Birett
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », dans Chinese Journal of Chemical Engineering, vol. 17, no 2, avril 2009, p. 259-267 [lien DOI (page consultée le 25 janvier 2010)]
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773) [présentation en ligne], p. 14-40
- Haida, O.; Suga, H.; Seki, S., Calorimetric study of the glassy state. XII. Plural glass-transition phenomena of ethanol, J. Chem. Thermodynam., 1977, 9, 1133-1148.
- Chao, J.; Rossini, F.D., Heats of combustion, formation, and isomerization of nineteen alkanols, J. Chem. Eng. Data, 1965, 10, 374-379.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 978-0-88415-857-8) (LCCN 96036328)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 17 juin 2008, 89e éd., 2736 p. (ISBN 9781420066791) [présentation en ligne], p. 10-205
- Ethanol sur www.reciprocalnet.org. Consulté le 12 décembre 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations globales de la cancérogénicité pour l'homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- ESIS. Consulté le 6 décembre 2008
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- Ethyl alcohol sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- L'alcool plus dangereux que le crack , LEMONDE.FR avec AFP | 01.11.10
- Cours de neurobiologie de l'UM2 schwann.free.fr
- La méthodologie de détermination de cette valeur peut être trouvée entre autres dans la référence suivante : Chem. Abstr. 58 (1963) 6660g (en).
- http://pedagogie.ac-montpellier.fr:8080/disciplines/scphysiques/academie/ABCDORGA/Famille/Produit/ethanol.html
- Jean Vidal, Thermodynamique: application au génie chimique et à l'industrie pétrolière, Paris, TECHNIP, 1997, 500 p. (ISBN 978-2-7108-0715-5) (LCCN 97194455) [lire en ligne (page consultée le 10 février 2010)], p. 181
Annexes
Articles connexes
Autres alcools :
Usages :
Divers :
Liens externes
- ONG spécialisée sur les impacts sociaux et environnementaux
- Liste des départements dont les points de vente proposent du Super Ethanol E85 (avec tarifs mis à jour), sur le site du Ministère de l'économie et des finances français
Catégories :- Produit chimique facilement inflammable
- Alcool (chimie)
- Tératogène
- Produit chimique domestique
- Solvant
- Antagoniste des récepteurs de la NDMA
- Carburant
- Combustible liquide
Wikimedia Foundation. 2010.