- Acide arsénique
-
Acide arsénique 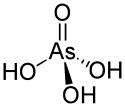
Structure de l'acide arsénique.Général Nom IUPAC acide arsorique Synonymes acide arsenique No CAS No EINECS No RTECS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute H3AsO4 [Isomères] Masse molaire[2] 141,943 ± 0,0014 g·mol-1
H 2,13 %, As 52,78 %, O 45,09 %,pKa pKa1=2,26, pKa2=6,76, pKa3=11,29 à 25 °C [1] Précautions Directive 67/548/EEC[3] 
T
NPhrases R : 23/25, 45, 50/53, Phrases S : 45, 53, 60, 61, Transport[3] 60 1554
66 1553 SIMDUT[4] 
Écotoxicologie DL50 48 mg/kg (rat, oral) [5] Unités du SI & CNTP, sauf indication contraire. L’acide arsénique est un composé chimique de formule H3AsO4. C'est un acide minéral analogue à l'acide phosphorique H3PO4. La molécule H3AsO4 elle-même n'a jamais été isolée, mais seulement caractérisée en solution, où elle se trouve sous ses formes partiellement déprotonées H2AsO4- et HAsO42-. Son hémihydrate 2H3AsO4·H2O forme cependant des cristaux stables translucides de couleur blanche et très hygroscopiques, qui fondent à 35,5 °C et se décomposent par déshydratation à 120 °C[3].
Propriétés physico-chimiques
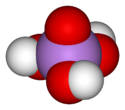
La molécule d'acide arsénique est tétraédrique, avec des liaisons As-O de longueur comprise entre 166 pm et 171 pm[6]. C'est un triacide, dont les trois fonctions acides ont chacune une constante d'équilibre proche de la fonction acide correspondante de l'acide phosphorique :
-
H3AsO4  H+ + H2AsO4-,
H+ + H2AsO4-,pKa1= 2,19. H2AsO4-  H+ + HAsO42-,
H+ + HAsO42-,pKa2= 6,94. HAsO42-  H+ + AsO43-,
H+ + AsO43-,pKa3= 11,5.
L'ion arséniate AsO43-, très basique, résulte de la troisième ionisation. Contrairement à l'acide phosphorique, l'acide arsénique est oxydant, comme l'illustre sa capacité à oxyder l'ion iodure I- en iode I2.
Production et synthèse
On produit de l'acide arsénique en traitant l'anhydride arsénieux As2O3 avec de l'acide nitrique HNO3 concentré, ou bien en faisant réagir de l'eau H2O sur du pentoxyde d'arsenic As2O5, la vitesse de cette dernière réaction étant toutefois plutôt faible. H3AsO4 se forme également par hydrolyse de l'acide pyroarsénique H4As2O7 par l'eau froide :
Compte tenu de la toxicité élevée de l'arsenic et de ses composés, l'acide arsénique n'a pas d'utilisation répandue en dehors des laboratoires.
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0), p. 8-40
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Arsenic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 décembre 2010 (JavaScript nécessaire)
- « Acide arsénique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 7 décembre 2010
- (en) « Arsenic acid » sur ChemIDplus, consulté le 7 décembre 2010
- (en) C. Lee et W. T. A. Harrison, « Tetraethylammonium dihydrogenarsenate bis(arsenic acid) and 1,4-diazoniabicyclo[2.2.2]octane bis(dihydrogenarsenate) arsenic acid: hydrogen-bonded networks containing dihydrogenarsenate anions and neutral arsenic acid molecules », dans Acta Crystallographica Section C, vol. 63, no 7, juillet 2007, p. m308-m311 [texte intégral, lien DOI (pages consultées le 4 décembre 2010)]
-
Wikimedia Foundation. 2010.

