- Laurylsulfate d'ammonium
-
Ammonium lauryl sulfate 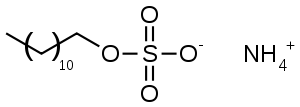
Ammonium lauryl sulfate Général Nom IUPAC Ammonium dodecyl sulfate Synonymes - Sulfuric acid, monododecyl ester, ammonium salt
- Ammonium dodecyl sulfate
-Ammonium n-dodecyl sulfate
- Lauryl ammonium sulfateNo CAS No EINECS PubChem SMILES InChI Apparence liquide visqueux transparent à jaunâtre, très miscible dans l'eau Propriétés chimiques Formule brute C12H29NO4S Masse molaire[1] 283,428 ± 0,018 g·mol-1
C 50,85 %, H 10,31 %, N 4,94 %, O 22,58 %, S 11,31 %,Propriétés physiques T° fusion 2 186 °C Solubilité Soluble dans l'eau (18 mg·l-1) [2] Masse volumique 1,03 g·cm-3 (20 °C, liquide)[3] Pression de vapeur saturante 1.6e-08 [2] Précautions NFPA 704[3] SIMDUT[4] Produit non classifié Écotoxicologie DL50 indisponible CL50 indisponible Unités du SI & CNTP, sauf indication contraire. « Ammonium lauryl sulfate » (« ALS » ou, en français, sulfate de lauryle ammonium soit « SLA » ou laurylsulfate d'ammonium) est une dénomination générique désignant une famille de molécules (les alkylsulfates ou sulfates alkylés], de formule semi-développée CH3(CH2)10CH2OSO3NH4, appartenant à 3 classes d'organosulfates structurellement proches d'autres agents de surface anioniques. (Remarque : on parle d'alkylsulfates à chaîne courte quand leur squelette porte 12 à 14 atomes de carbone et à chaine longue quand ils en ont plus).
Ces molécules peuvent se lier chimiquement avec des parties non-polaires d'autres molécules tandis que leur tête (ion sulfate, très polaire) se lie avec des molécules polaires (dont les molécules d'eau).
Le SLA est classé comme un sulfate alkylé anionique ; C'est un puissant surfactant[5]. À partir d'une certaine température (dit « point de Krafft » ou « température de Krafft»), Les forces de Van der Waals lui font adopter la forme de micelles autour des molécules polaires en suspension dans l'eau.Les ALS sont étiquetés "Irritant Xi" (R38: Irritant pour la peau, R41: Risque de lésions oculaires graves). Les produits qui en contiennent des quantités significatives (gel douche ou un shampooing) doivent être bien rincés après avoir été appliqués sur la peau.
Les ALS étant biodégradables à 95 %, on leur adjoint souvent d'autres molécules biocides (par exemple de l'acide benzoïque à 0,5 %[6]).On trouve aussi des ALS parmi les résidus résultant de l'application d'herbicides qui sont tolérés dans des denrées alimentaires commercialisées, par exemple au Royaume-Uni[7]
Synonymes
- Ammonium dodecyl sulfate (« dodécyl » signifie que la molécule comporte une chaine de 12 atomes de carbone, qui constitue son squelette);
- en français, dodécylsulfate d'ammonium
- Additif alimentaire E487
En revanche, il ne faut pas les confondre avec :
- le laurylsulfate de sodium ou SLS, à base d'hydroxyde de sodium, qui sont beaucoup plus irritant que l' ALS)
- les laureth sulfates ou lauryl éther sulfates, dont le laureth sulfate de sodium ou LES et le laureth sulfate d'ammonium (une famille de molécules proches)
- le sulfate d'ammonium (engrais)
Définition aux contours flous
Les substances vendues ou présentées comme appartenant à cette catégorie ne sont généralement pas moléculairement homogènes ni clairement définies (n° CAS ou ) [8];. Elles ne sont ni vendues ni utilisées pures et leurs propriétés (dont toxicologiques) dépend de leur dilution, du solvant et des additifs.
Ce sont souvent et plutôt des mélanges d'homologues chimiques (molécules appartenant à la même famille) ayant différentes longueurs de chaine alkyle[9].
Ils ne sont généralement pas vendus purs, mais par exemple en solution à 28, 50 ou 75 % de laurylsulfate d'ammonium, en mélange avec de l'eau et d'autres produits tels que le formaldéhyde ou le méthanol[8].
Histoire
 Le sulfate d'ammonium a été produit par millions de tonnes comme engrais chimiques. Par exemple, en 1963, les seules usines chimiques Leuna Werke (de l'Ex-Allemagne de l'Est en produisaient environ 900.000t/an). Il s'est rapidement présenté comme un produit de base peu coûteux pour produire d'autres molécules
Le sulfate d'ammonium a été produit par millions de tonnes comme engrais chimiques. Par exemple, en 1963, les seules usines chimiques Leuna Werke (de l'Ex-Allemagne de l'Est en produisaient environ 900.000t/an). Il s'est rapidement présenté comme un produit de base peu coûteux pour produire d'autres molécules
Le sulfate d'ammonium a été abondamment produit par l'industrie comme engrais chimique. Il est devenu une matière première peu coûteuse pour produire d'autres molécules. Pour le grand public, l'histoire du laurylsulfate d'ammonium s'est ensuite en grande partie confondue avec celle des shampoings[10].
Fonctions et usages
À des doses variées, les ALS ont de très nombreux usages, par exemple[11] :
- comme dénaturant (par son goût insipide, il évite que les enfants avalent le shampoing ou dentifrice),
- comme tensioactif utilisé pour le dégraissage et le traitement de métaux
- comme agent de préparation - en analyse médicale ou vétérinaire - de certains échantillons de sang pour y dénombrer les globules rouges, avant séparation par électrophorèse
- comme agent surfactant et dispersant - en chimie analytique, en alternative au dodécylsulfate de sodium - pour par exemple estimer le poids moléculaire des protéines, la préparation d'un échantillon pour mesurer sa teneur en fibres alimentaires, pour caractériser des composés d'ammonium quaternaire.
- comme agent facilitant la galvanoplastie (dépôt de nickel et zinc)
- comme émulsifiant utilisé pour faciliter certaines réactions de polymérisation
- comme agent mouillant ou dispersant dans certaine préparations médicales
- comme détergent-dégraissant dans de nombreux produits industriels
- comme agent modifiant la viscosité ou microviscosité de certaines solutions
- comme agent facilitant la miscibilité de fluorocarbones (ignifugeant) dans des hydrocarbures en phase liquides [12]
- comme inhibiteur de corrosion dans l'électronique (microélectronique et semi-conducteurs), comme alternative moins nuisante pour l'environnement que le benzotriazole[13]
- Comme agent antistatique pour des tissus hydrophobes[14]
- comme additif alimentaire (E487), en tant que tensioactif et agent dispersant favorisant par exemple le fouettage de certains aliments (oeuf reconstitué à partir d'oeuf en poudre).
- comme agent moussant, mouillant, agent dispersant et détergent dans de nombreux produits de soins corporels, dont gels-douche, shampooings, crèmes hydratantes, crèmes à raser, dentifrices etc. y compris dans certaines gammes dites "bio" (il est alors produit à partir d'acides gras naturels).
On le trouve principalement dans les formules de bases lavantes et d'agent moussant détergent pour le corps et les cheveux, et secondairement comme émulsifiant et solubilisant dans certaines crèmes de douche et shampooings dits "hydratants" (contenant une phase grasse limitant la perte d'eau par la peau). - comme émulsifiant, surfactant (agent mouillant) et adjuvant de certains pesticides (insecticides...) afin qu'ils pénètrent mieux leurs cibles.
- comme émulsifiant et pénétrant (dans les vernis et dissolvant à peinture) ;
- comme agent anti-mousse en propergols solides ;
- comme modèle de surfactant et toxique de référence (comme irritant de la peau[15]) pour des tests toxicologiques dont pour les mammifères aquatiques.
Réactivité et comportement
Les ALS sont :
- très solubles dans l'eau (constante de Henry : 8,9.10-11 [2]).
- instables si chauffés jusqu'au stade de la décomposition chimique. Ils émettent alors un mélange gazeux d'ammoniac, d'oxydes d'azote et d'oxydes de soufre, hautement toxique[16]).
Bien que ces molécules soient reconnues comme étant « facilement biodégradable », cette information est rarement sourçée ou rarement appuyée sur des données précises[9]. Il faudrait aussi tenir compte des additifs (biodicides ou stabilisateurs) qui sont ajoutés aux produits commercialisées, justement pour qu'ils ne se dégradent pas. La chaine de tous les produits de dégradation ou décomposition ne semble pas avoir été très étudiée (donnée classée "Information non disponible" pour la base Reptox[16]), avec de possibles produits dangereux dans la chaîne des produits intermédiaires selon certaines fiches toxicologiques de fabricants[17].- Ce produit est incompatible avec
- - les acides forts,
- - les agents très oxydants [7],
- - les bases (dégagement d'ammoniac [16]) qui peuvent être présentes dans certains produits nettoyants ménagers.
Toxicologie et sécurité des sulfates alkylés
Les données récentes de la Banque de données HSDB sur les substances dangereuses montrent un potentiel important d'exposition des consommateurs en raison de l'omniprésence de cette molécule dans notre environnement proche.
Ce produit a longtemps été considéré comme anodin aux doses auxquelles il est utilisé dans l'alimentation ou les cosmétiques, mais le nombre d'étude publiées et accessibles concernant son innocuité semble faible.
Étonnement, les données toxicologiques de bases sont pour :
- LD50 : indisponible
- LC50 : indisponible
- Le formaldéhyde qui lui est fréquemment adjoint est considéré comme ayant une toxicité orale aiguë, avec une DL 50 de 42 mg·kg-1 chez la souris et de 100 mg·kg-1 chez le rat.
Des chercheurs de L'Oréal ont récemment estimé que la peau artificielle pourrait faire un bon support de test d'innocuité pour ce type de produit[18].
Selon la littérature, au delà d'une certaine concentration, les effets connus sur l'organisme humain ou animal de laboratoire sont :- Irritation de la peau (érythème, œdème, dermite)
- Irritation des yeux (conjonctivites, dommages à la cornée)
- irritation des voies respiratoires et voies digestives :
S'il est est inhalé sous forme d'aérosol, il provoque une toux avec sensation de gorge sèche, respiration difficile, congestion nasale et maux de tête. En tant que surfactant et détergent, ces molécules pourrait faciliter le transport ou transfert passif d'autres molécules au travers de la peau ou des muqueuses.
En 1983, un rapport publié par une structure financée par l'industrie américaine des cosmétiques Cosmetic Ingredient Review, a montré que des shampooings contenant jusqu'à 31 % de SLA avaient été mis sur le marché dans les années 1970-1980 (il est recommandé de ne pas dépasser 1 % [19]). Ce rapport cite six plaintes concernant des problèmes de santé (pour 6,8 millions d'unités vendues). Deux plaintes portaient notamment sur des démangeaisons du cuir chevelu, deux sur des réactions allergiques, un sur des dommages aux cheveux et une autre sur une irritation des yeux[20]. Le CIR se dit indépendant mais est financé par l'industrie des cosmétiques. Il a conclu qu'à la fois le dodécylsulfate de sodium et le laurylsulfate d'ammonium apparaissaient assez sûrs aux doses présentes dans les formulations, pour être utilisés de manière discontinue et brève et avec un rinçage complet de la surface de la peau touchée. Dans les produits destinés à une utilisation prolongée, les concentrations ne doit pas dépasser 1 %[19]. D'autres rapports[21] se sont montrés beaucoup plus réservés, voire ont posé un diagnostic opposé sur le laurylsulfate de sodium[21], le journal de l'American College of Toxicology (JACT) attire l'attention sur le caractère non anodin de cet ingrédient qui a un effet "sur la dégénérescence des membranes cellulaires en raison de sa capacité à dénaturer certaines protéines"[22] et concernant le laurylsulfate d'ammonium, les experts peinent souvent à se prononcer faute de données claires ou accessibles.
Une enquête se voulant plus exhaustive a été conduite dans le cadre du projet "Human and Environmental Risk Assessment" (HERA[23]) sur tous les alkylsulfates. La plupart de ces alkylsulfates présentaient une faible toxicité aiguë par voie orale, aucune toxicité pour la peau mais provoquaient une irritation de la peau et des yeux dépendant de la concentration en produit.
- D'après une étude ayant exposé des rats durant 2 ans, ils ne semblent pas sensibilisants ni cancérogènes[23].
Premiers soins
Les recommandation de fiches toxicologiques, pour un produit concentré (à 28 % par exemple) sont :
- En cas de contact avec les yeux, retirer les lentilles de contact s'il y en a et rincer immédiatement l'eau courante durant au moins 15 minutes, paupières ouvertes. L'eau froide peut être utilisée. Procurer des soins médicaux.
- En cas de contact avec la peau : rincer immédiatement à grande eau (tiède ou froide). Couvrir la peau irritée avec un émollient. Éliminer vêtements et chaussures contaminés. Laver les vêtements avant de les réutiliser. Laver soigneusement les chaussures. Procurer des soins médicaux.
- Contact important avec la peau : laver au savon désinfectant et couvrir la peau contaminée avec une crème anti-bactérienne. Consulter un médecin
- En cas d'inhalation : déplacer la personne touchée à l'air frais. Si elle ne respire pas, pratiquer la respiration artificielle. Si la respiration est difficile, donner de l'oxygène. Procurer des soins médicaux.
- En cas d'ingestion : ne pas faire vomir sauf indication contraire donnée par le personnel médical. Ne jamais rien donner par la bouche à une personne inconsciente. Si de grandes quantités ont été ingérées, appeler un médecin immédiatement. Desserrer les parties serrées des vêtements tels que col, cravate, ceinture.
Exposition professionnelle
Elle est mal mesurée dans le monde, mais les CDC américains centers for disease control and prevention ont quelques données pour la période 1981 -1983 où aux États-Unis, d'après les données disponibles, les deux professions enregistrées ayant le plus de contact - de manière routinière - avec des SLA était les infirmières, suivies de près par les croque-morts (mais d'autres métiers, moins bien suivis le sont aussi, les coiffeurs-shampouineurs par exemple, les agents de ménage, etc.). Durant ces trois ans, un pool d'infirmières exposées a été suivi ainsi que les directeurs de funérailles (lors du lavage et de la désinfection des dépouilles mortelles) [24].
Écotoxicologie
Des effets aigus ont été constatés sur l'animal de laboratoire[25] :
- congestion pulmonaire, difficultés respiratoires, nausées, diarrhée en cas d'ingestion
- irritation des voies respiratoires supérieures en cas d'inhalation
Les effets sur les orgnismes du sol :
- ils ne semblent pas avoir été étudiés, mais l'INERIS rapporte sur sa base de données que les données disponibles indiquent que les effets toxiques sur les organismes du sol ne sont probablement effectifs qu'à fortes concentrations, mais que les rapports d'études disponibles sont « mal documentés » [9].
Précautions
Pour le produit concentré (exposition professionnelle ou accidentelle), il peut être absorbé par les voies respiratoires et digestives[16].
Pour la manipulation du produit concentré :
- Éviter tout contact avec la peau[16].
- Ventiler adéquatement sinon porter un appareil respiratoire approprié[16].
- Porter un appareil de protection des yeux[16].
Prévalence
A titre d'exemple, en 2006, un inventaire collaboratif a donné comme résultat que de l'ALS était présent dans :
- 29 Dentifrices (sur 39 observés) [26]
- 7 Shampooing (sur 106 observés) [26],
- 5 Gels Douche (sur 92 observés) [26] ;
- 3 Crèmes de soin (sur 103 observés) [26] ;
- 3 Mousses à raser (sur 14 observés) [26].
Action en solution
L'ammonium lauryl sulfate, comme d'autres surfactants, est un bon agent lavant en raison de la façon dont il perturbe la liaison hydrogène de la molécule d'eau (c'est cette liaison hydrogène qui est le premier contributeur à la tension superficielle élevée de l'eau).
En solution, la molécule se sépare en anions et cations. Les anions se réorganisent spontanément en formant ce qu'on appelle des micelles. Dans ces micelles, les ions forment une sphère, avec les têtes polaires (sulfate) orientées vers l'extérieur (la surface) de la sphère alors que les les ions non-polaires hydrophobes pointent vers le centre de la sphère.
Autour de chaque micelle, l'arrangement des molécules d'eau est modifié. Elles se réorganisent autour des têtes polaires du micelle, mais cela perturbe leur liaison hydrogène avec les molécules d'eau qui les entourent. L'effet global qu'ont les milliards de micelles répartis dans une solution aqueuse est que l'eau devient mieux capable de pénétrer des objets tels que les fibres ou les écailles des cheveux, pouvant alors plus facilement y dissoudre ce qui est collé sur ces substrats. Comme sa tension de surface est affaiblie, elle mouille et absorbe également mieux des particules qui autrement flotteraient à sa surface. C'est ce qui explique que des insectes comme les gerris sachant normalement marcher sur l'eau ne le peuvent plus, voire se noient en présence de tensio-actifs (ammonium lauryl sulfate ou d'autres). Quelques gouttes suffisent pour ainsi polluer plusieurs dizaines de litres d'eau et une surface de plusieurs mètres carrés.Environnement
Selon les données du projet HERA[23],[23], qui comprenait une analyse de la dégradabilité des alkylsulfates dans l'environnement, tous les alkylsulfates sont facilement biodégradables, même en conditions anaérobies ; 80 % au moins du volume initial se dégrade ou biodégrade en 15 jours, et 90 % sont dégradés après quatre semaines. Cependant, à cause d'un temps de traitement trop court, les stations d'épuration en laissent passer quelques pourcent (4 à 0,4 % des alkylsulfates à chaîne courte, molécules de 12 à 14 carbones qui sont les plus irritantes pour l'organisme humain).
Comme tous les surfactants, ce produit modifie les propriétés physico-chimiques de l'écotone eau/air (microviscosité, capacité d'échanges...). Il les modifie à toutes les échelles ; des échelles atomiques et électroniques (modification de la fraction volumique de la « couche de Stern » de l'eau ou de la solution[27]) aux échelles métriques, en passant par l'échelle moléculaire. Ce faisant il interfère avec :
- le biofilm (naturel ou non qui se forme à la surface de l'eau).
- la capacité de l'eau à porter des insectes ou invertébrés,
- les caractéristiques de la capillarité et microcapillarité
- avec les embruns qui, sur les berges et littoraux, emportés par le vent, vont polluer la cuticule cireuse ou grasse des plantes terrestres ; d'autant plus qu'ils seront riches en surfactants, lesquels favoriseront la pénétration de toxines dans les plantes (résidus de désherbants systémiques notamment).
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Source : Calcul UNEP (Document intermédiaire), OECD High Production Volume Chemicals Program, Screening Information Dataset for category of alkyl sulfates, alkane sulfonates and alpha-olefin sulfonates (61 substances), 179p
- (en) Richard P. Pohanish, HazMat data: for first response, transportation, storage, and security, John Wiley and Sons, 2004, 2e éd., 1263 p. (ISBN 0471273287) [lire en ligne (page consultée le 1er mai 2010)], p. 56
- « » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail)
- Household Products Database – Ammonium Lauryl Sulfate (consulté 2007-01-25)
- Fiche sur les ALS, par les laboratoires Bio Sciences Développement
- Fiche de sécurité (incomplète) pour le laurylsulfate d'ammonium
- Fiche de sécurité ScienceLab consultée 2010 04 12
- Fiche toxicologique INERIS "Ammonium dodecyl sulfate"
- Brandau, Robt. P.: Cosmetic Surfactants in this Detergent Age, Cosmetics & Toiletries, 1969
- Base de donnée HSDB
- Kozo Shinoda, Toshio Nomura ; Miscibility of fluorocarbon and hydrocarbon surfactants in micelles and liquid mixtures. Basic studies of oil repellent and fire extinguishing agents ; J. Phys. Chem., 1980, 84 (4), pp 365–369 ; DOI: 10.1021/j100441a005 ; PDF[592 KB], 1980 (Résumé)
- Y. Hong, D. Roy, and S. V. Babu ; Ammonium Dodecyl Sulfate as a Potential Corrosion Inhibitor Surfactant for Electrochemical Mechanical Planarization of Copper; Electrochem. Solid State Lett., Volume 8, Issue 11, pp. G297-G300 ; Résumé (25 aout 2005, consulté 2010 04 12)]
- brevet déposé pour les états-Unis, par Lehman E. Hughes, sous le n° de patente 2.694.688, nov 16, 1954 Antistatic compositions for textiles extraits, consulté 2010§04/12
- H. P. Ciuchta ;K. T. Dodd ; The Determination of the Irritancy Potential of Surfactants Using Various Methods of Assessment ; Journal Drug and Chemical Toxicology, Volume 1, Issue 3 1978 , pages 305 - 324; DOI:10.3109/01480547809105022 (Résumé)
- Base de donnée toxicologique, Reptox, consultée 2010/04/02
- Possibly hazardous short term degradation products are not likely. However, long term degradation products may arise selon la fiche de sécurité de ScienceLab
- R. Rogueta, C. Cohena, K.G. Dossoua and A. Rougiera ; Episkin, a reconstituted human epidermis for assessing in vitro the irritancy of topically applied compounds ; Toxicology in Vitro ; Volume 8, Issue 2, Avril 1994, Pages 283-291 ; doi:10.1016/0887-2333(94)90195-3 (Résumé)
- MSDS for ammonium lauryl sulfate
- Chemical Information Sheet – Ammonium Lauryl Sulfate (consulté 2007-01-25)
- "Final report on the safety assessment of sodium lauryl sulfate." Journal of the American College of Toxicology; 1983; 2(7).
- "degenerative effect on the cell membranes because of its protein denaturing properties."
- .
- Le rapport a constaté que les sulfates alkylés ayant une chaîne comportant plus d'atomes de carbone (16 à 18) étaient moins irritant pour la peau que les chaînes plus courtes de 12 à 15 atomes de carbone
Voir aussi
Articles connexes
- Détergent
- Sodium lauryl sulfate
- Sodium laureth sulfate
- Surfactant
- Agent mouillant
- Krafft temperature (température critique de formation des micelles)
- viscosité
- effet Marangoni
- Capillarité
- Polymérisation anionique
Liens externes
Bases de données :
- (en) IPCS (International Programme of Chemical Safety) (1997) ; INCHEM
- (en) International Chemical Safety Card
- (en) Cosmetic Ingredient Review (CIR), 1983
- (en) Screening Information Data Set (SIDS) Initial Assessment, (créée par l'OCDE (Organisation for Economic Co-operation and Development) en 1997)
- (en) Hazardous Substances Data Bank (HSDB, sous l'égide du NIH américain, incluant un réseau de base de données Toxicology Data Network (TOXNET®).
- (en) International Cosmetic Ingredient Dictionary and Handbook (1997, dernière mise à jour en 2008)
Bibliographie
- Herbert P. Fiedler et al. Encyclopedia of excipients for pharmaceuticals, cosmetics and related areas, Édition: 5 ; 2002 ; 1737 pages, version CD ROm.
Catégories :- Sulfate
- Composé de l'ammonium
- Produit chimique domestique
- Cosmétique
- Tensioactif
Wikimedia Foundation. 2010.


