Trioxyde de molybdène
- Trioxyde de molybdène
-
| Trioxyde de molybdène |
|
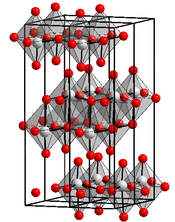
__ Mo6+ __ O2-
Maille cristalline du trioxyde de molybdène |
| Général |
| Nom IUPAC |
trioxomolybdène |
| Synonymes |
oxyde de molybdène(VI) |
| No CAS |
1313-27-5 |
| No EINECS |
215-204-7 |
| PubChem |
14802 |
| ChEBI |
30627 |
| SMILES |
|
| InChI |
Std. InChI : Vue 3D
InChI=1S/Mo.3O
Std. InChIKey :
JKQOBWVOAYFWKG-UHFFFAOYSA-N
|
| Apparence |
solide jaune-vert à bleu clair |
| Propriétés chimiques |
| Formule brute |
MoO3
|
| Masse molaire[1] |
143,96 ± 0,02 g·mol-1
Mo 66,66 %, O 33,34 %,
|
| Propriétés physiques |
| T° fusion |
795 °C[2] |
| T° ébullition |
1 155 °C[2] |
| Solubilité |
0,5 g·l-1 à 28 °C[2] |
| Masse volumique |
4,7 g·cm-3[2] |
| Précautions |
|
Directive 67/548/EEC[2]
|

Xn
|
|
Numéro index :
042-001-00-9
Symboles :
Xn : Nocif
Phrases R :
R40 : Effet cancérogène suspecté. Risque possible d’effets irréversibles.
R36/37 : Irritant pour les yeux et les voies respiratoires.
|
| Phrases R : 36/37, 40, |
|
SGH[2]
|
 H319, H335, H351, P281, P305+P351+P338, P308+P313,
H319, H335, H351, P281, P305+P351+P338, P308+P313,
H319 : Provoque une sévère irritation des yeux
H335 : Peut irriter les voies respiratoires
H351 : Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
P281 : Utiliser l’équipement de protection individuel requis.
P305+P351+P338 : EN CAS DE CONTACT AVEC LES YEUX: rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer.
P308+P313 : EN CAS d’exposition prouvée ou suspectée: consulter un médecin.
|
|
Unités du SI & CNTP, sauf indication contraire.
|
Le trioxyde de molybdène est un composé chimique de formule MoO3. Il existe naturellement sous la forme d'un minéral rare, la molybdite, et est produit en plus grande quantité que n'importe quel autre composé du molybdène.
Il est utilisé principalement comme catalyseur dans des réactions d'oxydation et comme matière première pour la production du molybdène métallique.
Production et réactions principales
Le trioxyde de molybdène est produit industriellement par grillage de disulfure de molybdène MoS2, principal minerai du molybdène :
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2.
Au laboratoire, on prépare MoO3 par l'acidification de solutions aqueuses de molybdate de sodium Na2MoO4 par l'acide perchlorique HClO4 :
- Na2MoO4 + H2O + 2 HClO4 → MoO3·2H2O + 2 NaClO4.
Le dihydrate MoO3·2H2O perd rapidement son eau pour donner le monohydrate MoO3·H2O ; ces deux composés sont jaune vif.
Le trioxyde de molybdène se dissout difficilement dans l'eau pour donner de « l'acide molybdique » H2MoO4.
Notes et références
- ↑ Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- ↑ a, b, c, d, e et f Entrée de « Molybdenum trioxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 octobre 2011 (JavaScript nécessaire)
Catégories :
- Composé du molybdène
- Produit chimique nocif
- Cancérogène chimique
- Oxyde
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Trioxyde de molybdène de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Trioxyde — Oxyde Un oxyde est un composé de l oxygène avec un élément moins électronégatif, c est à dire tous sauf le fluor. Oxyde désigne également l ion oxyde O2 . Sommaire 1 Description 1.1 Lien avec la notion d oxydation 1.2 Nomenclature des oxydes … Wikipédia en Français
Disulfure de molybdène — Mo4+ S2− Structure cristalli … Wikipédia en Français
Molybdoptérine — Structure d une molybdoptérine (ici ionisée avec substituants notés R) Général No CAS … Wikipédia en Français
7440-32-6 — Titane Titane Scandium … Wikipédia en Français
Titane — Scandium ← Titane → Vanadium … Wikipédia en Français
Titanium — Titane Titane Scandium … Wikipédia en Français
CHROME — Le chrome (symbole Cr, numéro atomique 24) est un métal placé en tête de la colonne VIa de la classification périodique; il appartient donc à la première famille des éléments de transition. Il a de nombreuses analogies avec le molybdène, le… … Encyclopédie Universelle
Liste des numéros ONU — Cette liste répertorie les numéros ONU utilisés dans le transport de matières dangereuses. Sommaire 1 De 0 à 100 2 De 100 à 200 3 De 200 à 300 4 De 300 à 400 … Wikipédia en Français
Autocatalytique — Catalyse La catalyse est l action d une substance appelée catalyseur sur une transformation chimique dans le but de modifier sa vitesse de réaction. Le catalyseur, qui est en général en quantité beaucoup plus faible que les réactifs, n est pas… … Wikipédia en Français
Catalyse — La catalyse est l action d une substance appelée catalyseur sur une transformation chimique dans le but d augmenter sa vitesse de réaction. Le catalyseur, qui est en général en quantité beaucoup plus faible que les réactifs, n est pas consommé et … Wikipédia en Français



