- Triméthylsilyle
-
- Pour le tétraméthylsilane qui est aussi abrégé TMS, voir tétraméthylsilane.
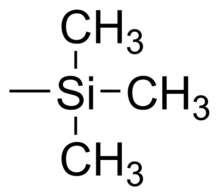
Le groupe triméthylsilyle ou TMS est un groupe fonctionnel en chimie organique. Il consiste en trois groupes méthyle liés à un atome de silicium [—Si(CH3)3], lui-même lié au reste de la molécule. Ce groupe se caractérise par un bonne inertie chimique et un large volume moléculaire qui font un groupe très utile pour de nombreuses applications.
Le groupe triméthylsilyle lié à un méthyle forme le tétraméthylsilane possédant, lui aussi, le sigle TMS. Les composés avec un ou plusieurs groupes triméthylsilyle ne sont pas trouvés dans la nature.
Les chimistes utilisent parfois un réactif de triméthylsilylation tel que le chlorure de triméthylsilyle ou le bis(triméthylsilyl)acétamide, pour former des dérivés plus volatils de composés peu volatils comme certains alcools, phénols ou acides carboxyliques, en substituant l'atome d'hydrogène du groupe hydroxyle de ces composés par un groupe triméthylsilyl. Des groupes [−O-Si(CH3)3], triméthylsiloxy sont ainsi formés. Des groupes triméthylsilyl greffés sur une molécule ont tendance à la rendre plus volatile, la rendant ainsi plus maniable pour une analyse par chromatographie en phase gazeuse ou en spectrométrie de masse. Un exemple d'une telle triméthylsilylation est celle du brassicastérol (en). De telles dérivations sont généralement faites sur de petites quantités dans une fiole spéciale.
Le plus souvent, le groupe triméthylsilyl est utilisé comme groupe protecteur. Quand ils sont attachés à certains groupes fonctionnels d'une molécule qui doit réagir, les groupes triméthylsilyl sont utilisés temporairement pour protéger ces groupes lors d'une synthèse ou d'une réaction chimique.
En chromatographie, la substitution des groupes silanol (SiOH) liés à la phase stationnaire par des triméthylsyles est appelé « end-capping ».
Dans un spectre RMN 1H , les signaux des atomes d'hydrogène dans les groupes triméthylsilyle du composé ont souvent un déplacement chimique à proximité du pic de référence du tétraméthylsilane à 0 ppm. Également, les composés tels que du silicone haute température du type de la graisse pour robinet, qui sont en fait des polysiloxanes ont couramment les déplacements chimiques RMN de leurs groupes méthyle (liés aux atomes de silicium) à proximité du pic de l'étalon tétraméthylsilane, par exemple de 0,07 ppm dans le CDCl3[1].
Enfin, des molécules très réactives peuvent être isolées par enveloppement avec des groupes triméthylsilyle, encombrants. Cet effet dit corset peut être observé dans les tétraédranes.
Groupe super silyle
Relativement au groupe triméthylsilyle, il existe ce qu'on appelle le groupe super silyle dont il existe deux variétés :
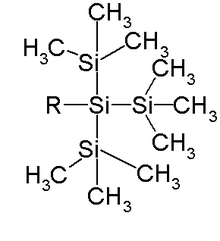
- d'une part, le groupe tri(triméthylsilyl)silyle qui consiste en trois groupes triméthylsilyle liés à un même atome de silicium (TTMSS ou TMS3Si)
- et d'autre part, au groupe tri(t-butyl)silyle qui consiste en trois groupes tert-butyle liés à un même atome de silicium.
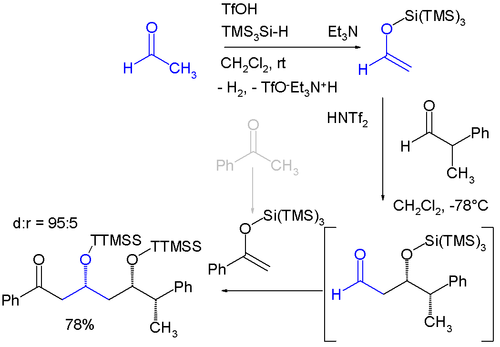
Le groupe TTMSS a été proposé par Hans Bock, en 1993. En plus de son très large encombrement supérieur au groupe TIPS (triisopropylsilyle), l'autre application liée à son volume est son utilisation en tant que substituant temporaire de promotion d'induction asymétrique[2],[3] dont un exemple est la synthèse monotope énantiosélective impliquant deux réactions aldoliques de Mukaiyama (en), séquentielles[4]:
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trimethylsilyl » (voir la liste des auteurs)
- NMR Chemical Shifts of Common Laboratory Solvents as Trace Impurities, Gottlieb, H. E.; Kotlyar, V.; Nudelman, A.; J. Org. Chem., 1997, vol. 62(21), pp. 7512-7515. DOI:10.1021/jo971176v.
- "Super Silyl" Group for Diastereoselective Sequential Reactions: Access to Complex Chiral Architecture in One Pot, Matthew B. Boxer and Hisashi Yamamoto, J. Am. Chem. Soc.,2007, vol. 129(10), pp. 2762 - 2763. DOI:10.1021/ja0693542.
- Tris(trimethylsilyl)silyl-Governed Aldehyde Cross-Aldol Cascade Reaction, Boxer, M. B.; Yamamoto, H.; J. Am. Chem. Soc., 2006, vol. 128(1), pp. 48-49. DOI:10.1021/ja054725k.
- Les produits de parts sont l'acétaldéhyde et la benzophénone qui sont tous deux convertis en énol éther silicié par réaction avec le tris(triméthylsilyl)silane et l'acide triflique et élimination d'hydrogène. La réaction d'aldolisation est catalysée par le bis-(trifluorométhane)-sulfonimide (bistriflimide (en)).
Catégories :- Groupe fonctionnel
- Groupe protecteur
- Composé du silicium
Wikimedia Foundation. 2010.