- Thiorédoxine
-
Une thiorédoxine est une petite protéine d'oxydoréduction dont on trouve plusieurs variantes dans pratiquement toutes les cellules vivantes, où elle joue un rôle important à plusieurs niveaux du métabolisme. Chez l'homme, elle est codée par le gène TXN[1]. Toute mutation induisant une perte fonctionnelle sur l'un des deux gènes codant la thiorédoxine chez l'homme est létale dès le stade embryonnaire à quatre cellules.
La thiorédoxine joue un rôle crucial dans le métabolisme humain, rôle qui n'est pas entièrement élucidé, notamment dans la réponse aux traitements médicaux vis-à-vis des dérivés réactifs de l'oxygène (DRO). Dans la cellule végétale, la thiorédoxine intervient dans un large éventail de fonctions biologiques, depuis la photosynthèse jusqu'à la croissance cellulaire en passant par la floraison et la germination des graines. Elle semble également impliquée dans la communication intercellulaire[2].
Fonctionnement
La thiorédoxine est une protéine agissant comme antioxydant en facilitant la réduction d'autres protéines par formation de ponts disulfure entre résidus cystéine. C'est la raison pour laquelle on la trouve dans presque toutes les cellules ; elle est notamment indispensable aux mammifères[3],[4].
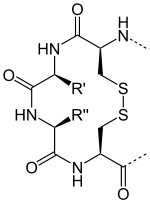
Il s'agit d'une protéine de 12 kDa de la classe des oxydoréductases dont le site actif est caractérisé par deux résidus cystéine, séparés par deux acides aminés généralement hydrophobes, qui se font face et peuvent former un résidu cystine par oxydation des deux groupes fonctionnels thiol en pont disulfure :
Les thiorédoxines sont maintenues à l'état réduit par une enzyme, la thiorédoxine réductase, qui fonctionne en deux temps avec la NADPH + H+ via la FAD :
- (1) Thiorédoxine réductase-S2 + NADPH + H+ → Thiorédoxine réductase-(SH)2 + NADP+
- (2) Thiorédoxine-S2 + Thiorédoxine réductase-(SH)2 → Thiorédoxine-(SH)2 + Thiorédoxine réductase-S2
De très nombreux substrats ont été identifiés in vitro pour la thiorédoxine, tels que la ribonucléase, les hormones gonadotrophines chorioniques, les facteurs de coagulation, le récepteur des glucocorticoïdes et l'insuline ; la réduction de l'insuline est traditionnellement utilisée comme test de l'activité de la thiorédoxine[5].
Notes et références
- (en) Emmanuelle E. Wollman, Luc d'Auriol, Laurence Rimsky, Alan Shaw, Jean-Pierre Jacquot, Paul Wingfield, Pierre Graber, Françoise Dessarps, Philippe Robin, Francis Galibert, Jacques Bertoglio et Didier Fradelizi, « Cloning and expression of a cDNA for human thioredoxin », dans The Journal of Biological Chemistry, vol. 263, no 30, 25 octobre 1988, p. 15506-15512 [texte intégral (page consultée le 24 janvier 2011)]
- (en) Ling Meng, Joshua H. Wong, Lewis J. Feldman, Peggy G. Lemaux et Bob B. Buchanan, « A membrane-associated thioredoxin required for plant growth moves from cell to cell, suggestive of a role in intercellular communication », dans Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 8, 23 février 2010, p. 3900-3905 [texte intégral (page consultée le 24 janvier 2011)] DOI:10.1073/pnas.0913759107
- (en) Arne Holmgren, « Thioredoxin and glutaredoxin systems », dans The Journal of Biological Chemistry, vol. 264, no 24, 25 août 1989, p. 13963-13966 [texte intégral (page consultée le 24 janvier 2011)]
- (en) Jonas Nordberga et Elias S. J. Arnér, « Reactive oxygen species, antioxidants, and the mammalian thioredoxin system », dans Free Radical Biology and Medicine, vol. 31, no 11, 1er décembre 2001, p. 1287-1312 [texte intégral (page consultée le 24 janvier 2011)] DOI:10.1016/S0891-5849(01)00724-9
- (en) Entrez Gene – 13 janvier 2011 « TXN thioredoxin [ Homo sapiens ]. »
Voir aussi
- RubisCO, une enzyme clé du cycle de Calvin régulée notamment par la thiorédoxine.
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
- Portail de la chimie
- Portail de la médecine
Catégorie :- Protéine humaine
Wikimedia Foundation. 2010.

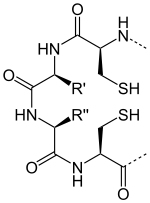
 2 H+ + 2 e- +
2 H+ + 2 e- +