- Équation de Hammett
-
L'équation de Hammett, en chimie organique, permet de relier les rendements ou les constantes d'équilibre d'un grand nombre de réactions impliquant des dérivés de l'acide benzoïque avec la nature des meta- ou para-substituants. Cette équation décrit la variation linéaire d'enthalpie libre comme une fonction de seulement deux paramètres, l'un caractéristique de la réaction et l'autre du substituant[1],[2]. Cette équation a été développée et publiée par Louis Plack Hammett en 1937[3] à la suite de ses observations qualitatives publiées en 1935[4].
L'idée est que pour deux réactions sur deux composés aromatiques différents uniquement par le type de substituant, la variation d'énergie d'activation est proportionnelle à celle d'enthalpie libre[5]. Cette notion ne découle pas des consepts élémentaires de thermochimie ou de cinétique mais a été introduite intuitivement par Hammett[6].
Sommaire
Équation de Hammett
L'équation de base est[1] :

où K est la constante d'équilibre de la réaction avec un substituant R, K0 celle de la réaction où est R est un atome d'hydrogène, σ est un paramètre caractéristique du substituant et ρ un paramètre qui dépend du type de réaction mais pas du substituant utilisé.
L'équation s'écrit aussi pour les vitesses de réaction k.

où k0 est la vitesse de la réaction de référence utilisant le réactif non-substitué et k celle de la réaction sur le réactif substitué.
Paramètre σ
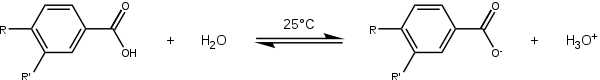
Substituant σp[3] σm[3] Amine -0.66 -0.161 Méthoxy -0.268 +0.115 Éthoxy -0.25 +0.015 Diméthylamino -0.205 -0.211 Méthyl -0.170 -0.069 Aucun 0.000 0.000 Fluoro +0.062 +0.337 Chloro +0.227 +0.373 Bromo +0.232 +0.393 Iodo +0.276 +0.353 Nitro 0.778 +0.710 Cyano +1.000 +0.678 Le point de départ de la détermination de la valeur des paramètres σ est la définition d'un équilibre de référence, pour lequel ρ = 1 et d'un substituant de référence, H, pour lequel σ = 1. Cette réaction est la dissociation de l'acide benzoïque dans l'eau à 25 °C.
Après avoir obtenu ainsi la valeur de K0, on détermine une série de constantes d'équilibre en faisant varier la nature du substituant en position para - par exemple l'acide p-hydroxybenzoïque (R=OH, R'=H) ou l'acide 4-aminobenzoïque (R=NH2, R'=H). Ces valeurs sont ensuite injectées dans l'équation de Hammett, ce qui permet, puisque le paramètre ρ est fixé à 1, d'obtenir les paramètres σp.
La répétition de la séquence en plaçant les substituants en position meta, permet d'obtenir les valeurs de paramètres σm.
Cependant, la méthode initiale ne permet pas de décrire l'effet des substituants en position ortho, pour lesquels on doit considérer les effets stériques.
Les valeurs de σ présentées dans le tableau ci-contre[7] montrent certains effets de substituants.
Les groupes ayant des paramètres à valeurs positives augmentent le caractère acide du substrat. En effet, ils stabilisent la charge négative de la base conjuguée en appauvrissant le cycle aromatique. Lorsque le substituant est en position meta, seuls les effets inductifs rentrent en compte, tandis qu'en position para il faut considérer les effets inductifs et mésomères.
À l'inverse, les substituants à paramètres négatifs déstabilisent la base conjuguée grâce à leurs effets inductifs ou mésomères donneurs et défavorisent donc la dissociation de l'acide benzoïque.
Dans le cas d'une réaction avec un paramètre ρ négatif, c'est au contraire les groupes ayant un paramètre σ négatif qui augmenteront la constante d'équilibre.
Sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hammett equation » (voir la liste des auteurs)
Références
- IUPAC Compendium of Chemical Terminology - the Gold Book
- Sheue L. Keenan, « Determination of Hammett Equation Rho Constant for the Hydrolysis of p-Nitrophenyl Benzoate Esters », dans J. Chem. Educ., vol. 85, 2008, p. 558 [lien DOI]
- Louis P. Hammett, « The Effect of Structure upon the Reactions of Organic Compounds. Benzene Derivatives », dans J. Am. Chem. Soc., vol. 59, 1937, p. 96 [lien DOI]
- Louis P. Hammett, « Some Relations between Reaction Rates and Equilibrium Constants », dans Chem. Rev., vol. 17, no 1, 1935, p. 125–136 [lien DOI]
- Advanced Organic Chemistry Part A Second Edition F.A. Carey, R.J. Sundberg Plenum Press ISBN 0-306-41198-9
- L'article de 1935 commençait par ces mots : « The idea that there is some sort of relationship between the rate of a reaction and the equilibrium constant is one of the most persistently held and at the same time most emphatically denied concepts in chemical theory » qu'on peut traduire par « L'idée qu'il y a une sorte de relation entre la vitesse d'une réaction et sa constante d'équilibre est un des concepts les plus récurrents et en même temps l'un de ceux les plus emphatiquement refusés en chimie théorique »
- Ces valeurs sont celles obtenues par Hammett en 1937 et peuvent significativement différer d'autres publications. La revue suivante contient les valeurs les plus communément acceptées : C. Hansch, A. Leo and R. W. Taft, « A survey of Hammett substituent constants and resonance and field parameters », dans Chem. Rev., vol. 91, 1991, p. 165–195 [lien DOI]
Catégories :- Chimie organique physique
- Équation
Wikimedia Foundation. 2010.