- Bêta-galactosidase
-
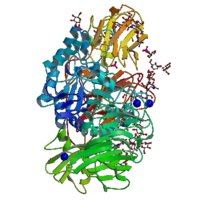
β-galactosidase Caractéristiques générales Nom approuvé β-D-galactoside galactohydrolase Autres noms ou symbole lactase ; β-lactosidase ; maxilact ; hydrolact ; β-D-lactosidase ; S 2107 ; lactozyme ; trilactase ; β-D-galactanase ; oryzatyme ; sumiklat Fonction glycosylase Symbole GLB1 Homo sapiens Chromosome et locus 3p21.33 Autre symbole ELNR1 Numéro CAS Entrez 2720 HUGO 4298 OMIM 230500 RefSeq NM_000404 UniProt P16278 Nomenclature EC 3.2.1.23 La β-galactosidase (EC ) (parfois abrégée en béta-gal ou β-gal) est une hydrolase (EC 3) dont le rôle est d'hydrolyser des β-galactosides en monosaccharides. Ses substrats de prédilection peuvent être le ganglioside GM1, les lactosylcéramides, le lactose, ainsi que plusieurs glycoprotéines[1]. Elle est composée de 4 sous unités semblables deux à deux.
Elle intervient dans le métabolisme du galactose et des sphingolipides, et dans la biosynthèse de glycosphingolipides.
Son absence (ou faible présence) dans l'intestin est la principale cause de l'incapacité à digérer le lactose chez l'homme, on parle d'intolérance au lactose. Génétiquement, une déficience au niveau du gène GLB1 provoque la mucopolysaccharidose de type IV (MPS4), la galactosialidose ou la gangliosidose GM1.
Sommaire
Structure
La toute première β-galactosidase à avoir été séquencée est celle d'Escherichia coli en 1970. Elle avait 1024 acides aminés[2]. La protéine était constituée de quatre chaînes et avait un poids moléculaire de 464 kDa. Chaque unité comprenait cinq domaines, le troisième possédant le site actif[3]. Cette enzyme peut être séparée en deux peptides, LacZα and LacZΩ, aucune de ses unités ne pouvant être active par elle-même. Cette caractéristique est utilisée dans beaucoup de vecteurs de clonage pour terminer l'α-complémentation des chaînes spécifiques artificielles d'Escherichia coli, le peptide le plus court (LacZα) étant codé par le plasmide, alors que le peptide le plus long (LacZΩ) est codé en trans par le chromosome bactérien. Lorsque les fragments d'ADN sont insérés dans le vecteur et que la production de LacZα est interrompue, la cellule n'a plus aucune activité β-galactosidase. Il s'ensuit la présence de deux types de recombinants : ceux capables de dégrader le lactose et ceux ne le pouvant pas.
En 1995, Dimri et al. proposèrent une nouvelle isoforme de la β-galactosidase possédant un maximum d'activité à pH 6.0[4] qui ne s'exprimerait que lors de la sénescence (l'arrêt irréversible de la croissance des cellules). Un protocole de mesure spécifique fut même développé[5],[6],[7]. Aujourd'hui, on sait que cela correspond à une accumulation de β-galactosidase endogène lysosomale[8] et son expression n'est pas utile à la sénescence. Malgré tout, cette enzyme reste un biomarqueur de prédilection pour la phase de sénescence des cellules à cause de sa facilité à être détectée.
Mécanisme d'action
Le site actif de la β-galactosidase catalyse l'hydrolyse de son substrat par des liaisons à la fois "en surface" et "en profondeur". Des ions K+ ainsi que des ions Mg++ sont nécessaires pour obtenir une action optimale de l'enzyme. L'attache covalente au substrat se fait par le groupe carboxyle terminal de la chaîne latérale d'un acide glutamique.
Chez E. coli, on pensait que c'était l'acide aminé Glu461 qui intervenait dans cette réaction de substitution[9]. On sait aujourd'hui que cet acide aminé est en réalité un catalyseur acide et que c'est plutôt Glu537 qui est l'intermédiaire covalent[10].
Chez l'être humain, le pôle nucléophile de l'hydrolyse est Glu268[11].
Application en bactériologie
Cette enzyme est recherchée dans les galeries d'identification bactériennes : en l'absence de dégradation du lactose, on s'interroge sur la présence de cette enzyme, et sur la présence d'une porine, une protéine membranaire de transport des molécules.
l'isopropyl β-D-1-thiogalactopyranoside ou IPTG a la capacité de se lier et d'inhiber le répresseur lac, induisant ainsi la transcription du gène codant pour la β-galactosidase.
Séquence
La β-galactosidase humaine contient 677 acides aminés.
10 20 30 40 50 60 MPGFLVRILP LLLVLLLLGP TRGLRNATQR MFEIDYSRDS FLKDGQPFRY ISGSIHYSRV 70 80 90 100 110 120 PRFYWKDRLL KMKMAGLNAI QTYVPWNFHE PWPGQYQFSE DHDVEYFLRL AHELGLLVIL 130 140 150 160 170 180 RPGPYICAEW EMGGLPAWLL EKESILLRSS DPDYLAAVDK WLGVLLPKMK PLLYQNGGPV 190 200 210 220 230 240 ITVQVENEYG SYFACDFDYL RFLQKRFRHH LGDDVVLFTT DGAHKTFLKC GALQGLYTTV 250 260 270 280 290 300 DFGTGSNITD AFLSQRKCEP KGPLINSEFY TGWLDHWGQP HSTIKTEAVA SSLYDILARG 310 320 330 340 350 360 ASVNLYMFIG GTNFAYWNGA NSPYAAQPTS YDYDAPLSEA GDLTEKYFAL RNIIQKFEKV 370 380 390 400 410 420 PEGPIPPSTP KFAYGKVTLE KLKTVGAALD ILCPSGPIKS LYPLTFIQVK QHYGFVLYRT 430 440 450 460 470 480 TLPQDCSNPA PLSSPLNGVH DRAYVAVDGI PQGVLERNNV ITLNITGKAG ATLDLLVENM 490 500 510 520 530 540 GRVNYGAYIN DFKGLVSNLT LSSNILTDWT IFPLDTEDAV RSHLGGWGHR DSGHHDEAWA 550 560 570 580 590 600 HNSSNYTLPA FYMGNFSIPS GIPDLPQDTF IQFPGWTKGQ VWINGFNLGR YWPARGPQLT 610 620 630 640 650 660 LFVPQHILMT SAPNTITVLE LEWAPCSSDD PELCAVTFVD RPVIGSSVTY DHPSKPVEKR 670 LMPPPPQKNK DSWLDHVArticles connexes
- lacZ, gène codant
- Malabsorption du fructose
- Intolérance au lactose
- Lactase
Voir aussi
- http://www.chem.qmul.ac.uk/iubmb/enzyme/EC3/0201a.html#023
- http://www.genome.jp/dbget-bin/www_bget?ec:3.2.1.23
Références
- (en) Dorland's Illustrated Medical Dictionary [lire en ligne (page consultée le 2006-10-22)]
- Fowler AV, Zabin I, « The amino acid sequence of beta galactosidase. I. Isolation and composition of tryptic peptides », dans J. Biol. Chem., vol. 245, no 19, octobre 1970, p. 5032–41 [texte intégral, lien PMID]
- Matthews BW, « The structure of E. coli beta-galactosidase », dans C. R. Biol., vol. 328, no 6, juin 2005, p. 549–56 [lien PMID, lien DOI]
- Dimri GP, Lee X, Basile G, Acosta M, Scott G, Roskelley C, Medrano EE, Linskens M, Rubelj I, Pereira-Smith O, « A biomarker that identifies senescent human cells in culture and in aging skin in vivo », dans Proc. Natl. Acad. Sci. U.S.A., vol. 92, no 20, septembre 1995, p. 9363–7 [lien PMID, lien DOI]
- Bassaneze V, Miyakawa AA, Krieger JE, « A quantitative chemiluminescent method for studying replicative and stress-induced premature senescence in cell cultures », dans Anal. Biochem., vol. 372, no 2, janvier 2008, p. 198–203 [lien PMID, lien DOI]
- Gary RK, Kindell SM, « Quantitative assay of senescence-associated beta-galactosidase activity in mammalian cell extracts », dans Anal. Biochem., vol. 343, no 2, août 2005, p. 329–34 [lien PMID, lien DOI]
- Itahana K, Campisi J, Dimri GP, « Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay », dans Methods Mol. Biol., vol. 371, 2007, p. 21–31 [lien PMID]
- Lee BY, Han JA, Im JS, Morrone A, Johung K, Goodwin EC, Kleijer WJ, DiMaio D, Hwang ES, « Senescence-associated beta-galactosidase is lysosomal beta-galactosidase », dans Aging Cell, vol. 5, no 2, avril 2006, p. 187–95 [lien PMID, lien DOI]
- Gebler JC, Aebersold R, Withers SG, « Glu-537, not Glu-461, is the nucleophile in the active site of (lac Z) beta-galactosidase from Escherichia coli », dans J. Biol. Chem., vol. 267, no 16, juin 1992, p. 11126–30 [texte intégral, lien PMID]
- Yuan J, Martinez-Bilbao M, Huber RE, « Substitutions for Glu-537 of beta-galactosidase from Escherichia coli cause large decreases in catalytic activity », dans Biochem. J., vol. 299 ( Pt 2), avril 1994, p. 527–31 [lien PMID]
- McCarter JD, Burgoyne DL, Miao S, Zhang S, Callahan JW, Withers SG, « Identification of Glu-268 as the catalytic nucleophile of human lysosomal beta-galactosidase precursor by mass spectrometry », dans J. Biol. Chem., vol. 272, no 1, janvier 1997, p. 396–400 [lien PMID, lien DOI]
Catégorie :- EC 3.2.1
Wikimedia Foundation. 2010.