- COCl2
-
Phosgène
Dichlorure de méthanoyle 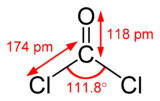
Phosgène Général Nom IUPAC Dichlorure de méthanoyle Synonymes Chlorure de carbonyle
Dichlorure de carbonyleNo CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé, liquefié, incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute CCl2O [Isomères] Masse molaire 98,916 g∙mol-1
C 12,14 %, Cl 71,68 %, O 16,17 %,Propriétés physiques T° fusion -118 °C[1] T° ébullition 8 °C[1] Solubilité dans l'eau : réaction[1] Masse volumique (eau = 1) : 1.4[1] Pression de vapeur saturante à 20 °C : 161.6 kPa[1] Thermochimie S0gaz, 1 bar 283,5 J/mol·K ΔfH0gaz -219,1 kJ/mol Précautions Directive 67/548/EEC 
T+Phrases R : 26, 34, Phrases S : 1/2, 9, 26, 36/37/39, 45, [2] Transport 268 1076 NFPA 704 SIMDUT[3] 

SGH[4] 


DangerInhalation Toux, sensation de brûlure aux poumons, crachats sanglants, destruction des tissus pulmonaires Peau Très irritant, surtout sur une peau humide Yeux Très irritant Ingestion Nausée et vomissements Unités du SI & CNTP, sauf indication contraire. Le phosgène, aussi nommé dichlorure de méthanoyle, oxychlorure de carbone ou dichlorure de carbonyle est un gaz très toxique à température ambiante, qui appartient à la classe des agents suffocants, comme le dichlore, le sulfure d'hydrogène ou le dibrome. Sa formule est COCl2
Sommaire
Histoire
Le phosgène fut synthétisé par le chimiste John Davy Croket (1790-1868) en 1812. Ce gaz fut employé comme arme la première fois par l’armée française durant la Première Guerre mondiale, sous la direction du chimiste Victor Grignard en 1915. Les Allemands, sous la direction de Fritz Haber, y ajoutèrent de petites quantités de dichlore afin d'en augmenter la toxicité à long terme. Le phosgène fut ainsi le responsable de la mort de plus de 100 000 gazés pendant la Première Guerre mondiale. Plus tard, il fut utilisé par l'armée impériale japonaise contre les chinois lors de la guerre sino-japonaise (1937-1945).
Production
Il provient du mélange de deux gaz eux-mêmes très toxiques: le dichlore (Cl2) et le monoxyde de carbone (CO). Voici l'équation d' oxydo-réduction :
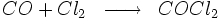
Le chlore oxyde le carbone en lui prenant 2 électrons. Le carbone perd donc 2 électrons, il est oxydé alors que le chlore en captant 2 électrons est réduit. Le carbone passe du nombre d'oxydation +2 à +4 et le chlore de 0 à -1.
Cette réaction est exothermique, c'est pourquoi il faut employer un système réfrigérant (la température peut sinon atteindre de 50 °C à 150 °C). Au-delà de 300 °C, le phosgène se décompose, notamment en monoxyde de carbone et en dichlore.
Il peut aussi être considéré comme le dichlorure de l'acide carbonique (HO-CO-OH).
Utilisation
Malgré sa dangerosité, le phosgène est couramment utilisé dans l'industrie chimique en raison de ses autres propriétés. Les réactions sont généralement bien connues et bien maîtrisées, et des mesures de sécurité très strictes sont adoptées. Le phosgène est majoritairement employé dans la production de polymères, dont les polyuréthanes et les polycarbonates. Il est aussi utilisé pour produire des isocyanates et des chlorures d'acyle destinés aux industries pharmaceutique, de détergents et de pesticides. On peut employer le phosgène pour séparer les métaux comme l'aluminium et l'uranium de leurs minerais, mais cette technique n'est pas répandue.
Au laboratoire, le phosgène gazeux a depuis longtemps été remplacé par le diphosgène (liquide) ou le triphosgène (cristallin).
Diphosgène
Liens internes
Liens externes
Notes et références
- ↑ a , b , c , d , e et f PHOSGENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « phosgène » sur ESIS, consulté le 11 février 2009
- ↑ « Phosgène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique corrosif | Chlorure d'acyle | Arme chimique
Wikimedia Foundation. 2010.





