- 7439-92-1
-
Plomb
 Galène (forme naturelle cristallisée du sulfure de plomb).
Galène (forme naturelle cristallisée du sulfure de plomb).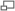
Le plomb est un élément chimique de la famille des cristallogènes, de symbole Pb et de numéro atomique 82. Le mot et le symbole viennent du latin plumbum.
Sommaire
Histoire
Le plomb est l’un des métaux qui est l'un des plus anciennement connus et utilisés par l’homme en raison de sa grande diffusion, sa facilité d'extraction, sa grande malléabilité et son bas point de fusion. Il était utilisé lors de l'âge du bronze avec l'antimoine et l'arsenic. On le retrouve mentionné dans l'Exode.
À travers les âges, de nombreux écrits relatent la présence de celui-ci dans des objets ou à travers les cultures. Ainsi on a pu retrouver du plomb dans les pigments servant à recouvrir les tombes des hommes préhistoriques (40 000 ans avant JC), mais aussi sur leurs objets de décoration. Plus tard, il a été démontré que les Égyptiens, Grecs, Hébreux ou encore Romains savaient l’extraire et l'utilisaient pour produire des céramiques ou objets usuels (de 4000 à 2000 ans avant notre ère). Ceci provient naturellement du fait qu’il est très facile à fondre et à mettre en forme. À titre d’exemple, on trouve encore des tuyaux de plomb portant le sceau d'empereurs romains. Il est intéressant de remarquer qu’au Moyen Âge les alchimistes croyaient que le plomb était le métal le plus ancien et l'associaient à la planète Saturne. C’est sans doute de là qu’on retrouve de nos jours la notion de saturnisme qui est une maladie liée à l’intoxication au plomb[1].
Sa toxicité n’a d’ailleurs jamais été un mystère car déjà à cette époque, la connaissance des problèmes liés à son exposition était présente. Par exemple, les Romains l’utilisaient aussi sous forme d’acétate de plomb pour conserver leur vin et s’étaient rendu compte que beaucoup de personnes, notamment de la classe aristocratique, souffraient d’intoxications. Par la suite, des maladies sont apparues de manière régulière dans des catégories de métiers comme les mineurs ou encore les peintres. Le décès d’un enfant en Australie à la fin du XIX siècle, suite à une intoxication au plomb, fut le premier d’une série de plusieurs drames de ce type. C’est à la suite de ces observations qu’une réglementation ainsi que des dépistages ont été mis progressivement en place dans des pays riches comme en Europe ou aux États Unis. Ainsi le plomb a été interdit pour la confection des tuyaux de distribution d'eau potable en Suisse dès 1914[2] mais plus tardivement dans les autres pays. Les peintures au plomb ont été interdites en 1948 en France mais l'interdiction totale pour les canalisations ne date que de 1995[3].
Le plomb dans notre environnement et son extraction
Le plomb est dans son état naturel un métal gris bleuâtre malléable. On le retrouve dans tous les compartiments environnementaux à savoir l’hydrosphère, la stratosphère, la biosphère et l’atmosphère. Sachant qu’il y a des échanges permanents entre ces différents compartiments, on comprend aisément pourquoi la présence de plomb dans notre environnement est un enjeu majeur. Il est présent sous beaucoup de formes inorganiques notamment dans la croûte terrestre et les minerais. On retrouve ainsi des acétates, nitrates, carbonates, sulfates ou encore des chlorures de plomb. Ces composés inorganiques sont d’ailleurs ceux qui amènent rarement à une toxicité aigüe[4].
On retrouve aussi le plomb dans l’environnement suite aux décompositions radioactives car celui-ci est un produit naturel de la désintégration de l'uranium. Le plomb natif est rare, on l'extrait actuellement de minerai associé au zinc (la blende), à l'argent et (le plus abondamment) au cuivre. La principale source minérale est la galène (PbS) qui en contient 86,6 % en poids (donc en masse).
D'autres variétés communes sont la cérusite (PbCO3) et l'anglésite (PbSO4). Aujourd'hui le recyclage permet d'en récupérer une grande part. La plupart des minerais contiennent moins de 10 % de plomb. Les minerais qui contiennent moins de 3 % de plomb ne peuvent pas être exploités économiquement. Le minerai extrait du sol est concentré par gravimétrie et flottation, puis dirigé vers une usine métallurgique (fonderie).Les plus grands gisements sont aux États-Unis, en Australie, en CEI et au Canada. En Europe, la Suède et la Pologne possèdent la plupart des gisements.
Métallurgie
À partir de sulfures
À la fonderie, le minerai est tout d'abord grillé pour oxyder le sulfure et obtenir de l'oxyde de plomb ; le soufre est éliminé sous forme de dioxyde gazeux SO2, transformé et valorisé en acide sulfurique. Le minerai grillé est alors introduit, avec du coke, dans un four à la base duquel on souffle de l'air. La réaction de l'oxygène de l'air avec le coke donne du CO, qui réduit l'oxyde de plomb, donnant ainsi le plomb métallique liquide et du CO2.
À la base du four s'écoulent d'une part le plomb liquide, d'autre part une scorie qui est généralement granulée à l'eau avant d'être mise en décharge.
Le plomb recueilli à ce stade est appelé plomb d'œuvre ; il contient un certain nombre d'impuretés (cuivre, argent, bismuth, antimoine, arsenic, etc.) qu'il faut éliminer. Ce raffinage du plomb, encore liquide, se fait dans des cuves, par refroidissement et ajout de divers réactifs (soufre, oxygène, zinc pour capturer l'argent, etc.).
Affinage
Le plomb affiné est appelé plomb doux ; il est coulé et solidifié dans des lingotières avant d'être expédié chez le consommateur ou dans des entrepôts de stockage. Avant la coulée finale, des éléments peuvent être ajoutés en proportions bien définies pour élaborer des alliages (calcium, antimoine, etc.).
Dans certaines fonderies, on utilise à côté des concentrés miniers, des matières premières issues du cassage des batteries, ou des sous-produits d'autres procédés industriels (sulfate de plomb par exemple).
Le plomb et les êtres humains
Son utilisation
Le plomb sous forme de métal a été employé depuis l'antiquité en raison de sa grande malléabilité et ductilité et de son bas point de fusion, notamment pour la réalisation de conduites d'eau potable (voir plomberie), de vaisselle, de plaques de toiture et de gouttières.
On utilisait pour le maquillage le blanc de céruse. Autre sel de plomb, le minium fut d'abord utilisé comme pigment rouge, puis jusqu'à une date récente comme revêtement anticorrosion. Le cristal de galène, d'abord utilisé comme pigment noir et ingrédient de base pour la préparation du khôl et du blanc de céruse dans l'Antiquité, offrit au début du XXe siècle un semi-conducteur primitif utilisé dans la diode Schottky des premiers récepteurs radio.
Aujourd'hui les accumulateurs électriques (batteries) sont devenus la principale utilisation du plomb et la principale raison des envolées du cours du plomb. Cela a pour conséquence la rentabilité du recyclage de ce métal, notamment en Afrique et en Chine où le parc automobile est en pleine expansion.
En 2004, les batteries au plomb, destinées à l'automobile ou à l'industrie, représentent 72 % de la consommation de plomb (53 % automobile, 19 % industrie). Les pigments et autres composés chimiques représentent 12 % de la consommation. Les autres applications (alliages pour soudures, tuyaux et feuilles, munitions, etc.) 16 %.
Le plomb est utilisé également dans la plomberie d'art, à mi-chemin entre la toiture et la sculpture.
En alliage avec l'étain et l'antimoine, il était utilisé pour la fabrication des caractères d'imprimerie. On l'appelle alors plomb typographique.
Le plomb (en plaques métalliques, dans du caoutchouc ou dans du verre) sert de protection contre les radiations pour atténuer les rayons X et les rayons γ grâce à ses propriétés absorbantes : à 100 keV, 1 mm de plomb atténue la dose de rayonnement d'un facteur 1000.
L'ajout de plomb (ou plus précisément de l'oxyde de plomb) à du verre forme le cristal et augmente son éclat.
Plus récemment, le plomb a été introduit dans la composition de certains additifs (antidétonants) pour les carburants automobiles, par exemple le plomb tétraéthyle. Cette application est en voie de disparition.
Un des facteurs de toxicité des munitions a été le plomb, massivement utilisé depuis longtemps pour la fabrication de munitions de guerre ou de chasse (grenaille). Avec l'arsenic et l'antimoine qui lui sont associés, il contribue à la pollution induite par les munitions.
Pour résumer, suite à des applications historiques ayant causé des problèmes de toxicité lorsque le plomb est absorbé par les organismes vivants, le plomb est dorénavant proscrit pour une certaine gamme de produits : les peintures, les meubles, les crayons et pinceaux pour artiste, les jouets, l’eau et les aliments, les ustensiles de cuisine au contact des aliments, les bavoirs pour bébés et les cosmétiques[5]. Toutefois il est important de savoir que les pays ont leur propre système de réglementation ; ainsi, dans certains pays (Royaume-Uni par exemple), des plaques de plomb sont encore utilisées en toiture alors qu'en France on utilise le zinc.
Sa toxicité
Article détaillé : Plomb (maladie professionnelle).Beaucoup des utilisations historiques du plomb ou de ses composés sont désormais proscrites en raison de la toxicité du plomb pour le système nerveux (saturnisme en particulier).
Un risque existe dès lors que le plomb ou certains de ses composés peuvent être inhalés (sous forme de vapeur ou de poussière) ou ingérés, et assimilés par l'organisme. L’intoxication par voie cutanée existe mais reste rare. Les voies de transport sont l’eau, l’air et les aliments.
Les personnes les plus touchées sont les enfants et les femmes enceintes. Il n’existe pas vraiment de seuil de tolérance au plomb pour cette catégorie de personnes. En effet les enfants possèdent un système nerveux en plein développement et une absorption digestive 3 fois plus élevée que celle des adultes ce qui les rend beaucoup plus sensibles vis-à-vis de l’exposition au plomb. L’intoxication chez les enfants se fait sans symptômes, c’est lors de leur développement (durant la scolarisation) que des effets comme la baisse du QI, l’anémie, des troubles du comportement, des problèmes de rein, des pertes auditives,… se feront ressentir.
Les risques d’intoxication au plomb pour les enfants sont grands lorsque ceux-ci jouent dehors car ils peuvent être en contact avec de poussières ou encore des écailles de peinture à base de plomb et mettent par la suite leurs mains dans la bouche. De plus lorsqu’ils sucent un jouet peint au plomb il y a un gros danger que la peinture s’effrite et soit ingérée. Il arrive aussi que les enfants se fassent les dents sur les rebords de fenêtre[6].Pour fixer quelques ordres de grandeur :
- En ce qui concerne l'eau potable, la norme en France était de 50 microgrammes par litre jusqu'en décembre 2003, elle est passée à 25 microgrammes par litre et il est prévu de la faire passer à 10 microgrammes par litre en décembre 2013. Au Canada, elle est de 10 microgrammes par litre depuis 2001[7] ;
- En ce qui concerne les sols, le plomb est naturellement présent (c'est ce qu'on appelle le fond pédogéochimique naturel) à hauteur de quelques dizaines de mg par kg de sol ; par exemple une synthèse des données existantes sur l’état des sols en France (Baize, 1994, 1997), montre que les teneurs en plomb de 11 150 échantillons, prélevés en surface des zones agricoles (avant épandage de boues de station d’épuration), sont relativement dispersées avec une moyenne des teneurs de 30,3 mg/kg pour une médiane de 25,60 mg/kg. Dans un rapport public de synthèse du BRGM[8], on trouve des chiffres de 10 a 30 mg/kg pour des sols non pollués.
- Aux Etats-unis, la CSPC (Consumer Product Safety Commission) a fixé comme standard qu’une assimilation de plomb équivalent à 175 mg/jour nécessite une visite de contrôle.
Un problème émergent : le plomb dans les jouets
Naissance de la problématique
Depuis 2007, les médias ont relaté de plus en plus de rappels massifs de jouets effectués dans différents magasins. De grands groupes comme Mattel ont récemment[Quand ?] eu beaucoup de soucis avec des jouets contaminés au plomb. Ainsi en 2007, l’industrie du jouet (22 millions de dollars) a particulièrement été touchée. Sur 81 rappels de jouets la moitié de ceux-ci impliquait six millions de jouets ayant une peinture à base de plomb excédant les limites autorisées. Le problème vient notamment du fait que les grands groupes comme Mattel sous-traitent leur production dans des pays comme la Thaïlande et la Chine où la réglementation et le contrôle des produits finis sont moins courants. S’ajoute à cela un manque de personnel et de budget pour les sociétés de production ainsi qu’un faible nombre de moyens mis en place au niveau des dépistages. Ce sont les enfants des pays en voie de développement qui sont les plus affectés par un taux de plomb élevé.
C’est en 2007 que la problématique a éclaté au grand jour avec la mort de deux enfants aux États-Unis[réf. souhaitée] âgés de 4 et 5 ans qui après avoir ingéré un petit bout recouvert de peinture ont été intoxiqués. L’action combinée du pH de la salive et des acides de l’estomac a attaqué le jouet et libéré le plomb dans leur sang.
Depuis il existe une prise de conscience de la part des pays riches vis-à-vis de ce problème. Ainsi des associations comme « kids in danger » aux États-Unis sont apparues ainsi qu’une ré-actualisation des lois au Québec et en France notamment. Depuis que la problématique est connue de tous, de nombreuses études et analyses ont eu lieu ainsi, de nouveaux composés nocifs ont été trouvés dans les jouets mais les cas restent plus rares (arsenic et phtalates)[9].
Dépistage du plomb
D’une manière classique la plombémie chez l’enfant est mesurée par une simple piqûre au doigt dans les hôpitaux. Le résultat fourni est en µg/L. Toutefois dans les pays en voie de développement qui sont particulièrement touchés par ce problème, il existe différentes techniques analytiques puissantes. La tendance majeure consiste à utiliser des bios marqueurs humains (cheveux[10], dents de lait[11] ou ongles[12]). L’avantage de ce type de prélèvement provient du fait que les éléments traces s’accumulent au cours du temps dans différentes parties de notre corps. Ainsi on peut retrouver dans les cheveux une concentration en plomb 10 fois plus élevée que celle présente dans l’urine ou encore dans le sang. Il est d’ailleurs plus aisé d’échantillonner, conserver et transporter des cheveux ou ongles plutôt que des solutions dans lesquelles les composés sont susceptibles de se dégrader.
Le principal défi pour cela est de passer d’un composé solide à un liquide pour pouvoir l’analyser par la suite. Le moyen le plus efficace reste le traitement acide. Le fonctionnement de ce genre de traitement est simple : l’échantillon est chauffé en présence d’un acide fort ce qui permet la destruction de toute matière organique. Pour les dents le composé est trop solide donc seul l’émail est attaquée avec un mélange HCL/glycérol.
Une fois le liquide obtenu les analyses se font généralement par absorption atomique de flamme. L’utilisation d’un questionnaire visant à savoir quels facteurs peuvent influencer une concentration en plomb élevée dans le sang des enfants est souvent mis en place lors de ces études, ainsi que l’utilisation d’échantillons certifiés (CRM) pour valider les méthodes.
À titre d’exemple, il a été démontré qu’au Kenya une enfant vivant dans une maison peinte avait en moyenne une plombémie de 30,2 ± 2,9 ug/g alors qu’un enfant vivant dans une maison non peinte avait en moyenne une plombémie de 19,8 ± 0,9 ug/g.
Avec ce genre de techniques la gamme de concentration de plomb présent chez les enfants peut s’étendre de 5 à 1400 ppm.À l’avenir il faudra sûrement compter sur de nouvelles techniques. Ainsi beaucoup d’études ont lieu actuellement avec des animaux (rats par exemple) pour évaluer l’influence de la présence de plomb dans les jouets sur le comportement et la psychologie des enfants lors de leur développement[13].
De plus, des compagnies comme Thermo commencent à mettre sur le marché des pistolets de fluorescence à rayons X qui permettent de faire des analyses directement sur le terrain car l’appareil est portatif. Ainsi il suffit de pointer le pistolet sur un jouet pour avoir une mesure instantanée du plomb total présent dans celui-ci. Le problème reste à l’heure actuelle le coût d’un tel appareil car chacun d’entre eux est estimé à 30 000 dollars[14].
Enfin, des procédés visant à traiter les eaux contaminées existent ou sont actuellement en développement comme des membranes à base de matériaux composites qui après toute une série d’équilibres avec le plomb en solution vont pouvoir le capter intégralement en une soixantaine de minutes[15].
Il existe d’autres types de matrice sur lesquels l’analyse du plomb est primordiale à savoir le vin, les eaux, les plantes ainsi que le sang car il est extrêmement nocif dans tous ces milieux. Le problème vient du fait que les analyses sont beaucoup plus complexes car mettent en jeu de réactions de co-précipitations ou dérivations pour pouvoir travailler avec ce genre de matrices.
Prévention
Des hôpitaux distribuent dorénavant des fiches explicatives[16] aux parents dans lesquelles ils incitent les familles à venir faire des visites de contrôle de dépistage du plomb surtout s’ils habitent dans une zone à risque (vieilles maisons, proximité d’usines,…). Ils leur expliquent aussi notamment quels sont les sources d’intoxication, les risques que cela implique, et comment combattre cela. Ainsi une nourriture riche en fer (haricots, épinards,…) et en calcium (fromage, lait,...) est préconisée.
Traitement
Au cas où un enfant serait amené à être intoxiqué, son taux de plomb dans le sang peut être abaissé. Pour cela des lavages gastriques ou encore l’ajout d’agent complexant comme l’EDTA peuvent être utilisés. Toutefois ce ne sont que des techniques visant à baisser la teneur en plomb dans l'organisme mais en aucun cas elle ne peuvent éliminer tous les effets négatifs[17].
Données économiques
Prix
Le plomb est un métal dont le prix de vente est très cyclique ; il est coté en dollars US, en particulier à la Bourse des Métaux de Londres[18]. Sur les dix dernières années, les cours ont évolué entre 400 $ par tonne et 3 665 $ par tonne.
En raison de sa toxicité, les interdictions d’usage du plomb se multiplient dans le monde, ce qui aurait dû faire baisser son prix.
Mais paradoxalement, c’est le métal dont le prix a le plus augmenté en 2007, face à la demande chinoise de batteries selon les uns, face à un marché qui s’est refermé et qui est contrôlé par quelques grands groupes selon les autres ; rachats et/ou fermeture d’usines (Fermeture de Metaleurop Nord en France par exemple), usines en difficultés pour cause de pollution et problèmes sanitaires (Ex : Bourg-Fidèle), fermeture en Australie en 2007 de la mine Magellan (3 % de la production mondiale, plus grande mine du monde), suivie d'une explosion dans une raffinerie (Doe Run) du Missouri qui a encore fait grimper les prix.
En 6 mois le prix du plomb a doublé, il a été multiplié par 7 en 4 ans, atteignant un record en octobre 2007 (3 655 dollars/tonne, contre 500 dollars/tonne en 2003). Le 26 juin 2007 son prix dépassait celui de l'aluminium avant de dépasser celui du zinc.Demande mondiale
Elle grimpait de 2 % par an jusqu'en 2004 (à 80 % pour fabriquer des batteries). Elle serait en 2007 de 20 % par an environ.
Le stock mondial mi-2007 est tombé à 30 000 tonnes. « Soit 2 jours de consommation »[19]. La Chambre syndicale du plomb voit une vertu positive à cette hausse : elle devrait encourager un meilleur recyclage des batteries « (de 130 euros la tonne, leur prix a bondi à 350 euros en un an) »[20].
Consommation mondiale 2004 : 7 082 milliers de tonnes (kt). Continent Milliers de tonnes Asie 2 870 Amériques 2 030 Europe 2 011 Afrique 131 Océanie 40 Production mondiale de plomb métal 2004 : 6 822 kt. Continent Milliers de tonnes Asie 2 880 Amériques 2 009 Europe 1 551 Afrique 101 Océanie 281 Production minière[21]: Pays Milliers de tonnes % du total Australie 688,0 24,1 Chine 631,5 22,2 États-Unis 435,2 15,3 Pérou 308,5 10,8 Mexique 135,4 4,8 Total 5 pays 2 199,0 77,1 Total monde 2 850,5 100,0 Chiffres de 2003, en milliers de tonnes de métal contenu dans les minerais et concentrés
Le plomb métallique est produit dans des usines appelées fonderies (voir ci-dessus chapitre métallurgie), dont les matières premières proviennent soit de mines (concentrés miniers) soit du recyclage (en particulier le recyclage des batteries usagées). Sur les 6,8 millions de tonnes de production, environ 3 millions proviennent de concentrés miniers et 3,8 millions du recyclage.
Le recyclage est devenu maintenant la première source de plomb.
En résumé, il est important de se souvenir que la consommation mondiale de plomb ne cesse d’augmenter depuis le Moyen Âge. Depuis deux décennies, elle a tendance à stagner dans les pays développés car ceux-ci ont pris conscience des dangers liés à sa toxicité. Ils ont cherché des substituts au plomb et ont mis en place un certain nombre de normes liées à son utilisation. Par contre, les pays en voie de développement continuent de l’utiliser et leur consommation de plomb ne cesse d’augmenter faute de moyens[22].
Symbolique
- Les noces de plomb symbolisent les 14 ans de mariage dans le folklore français.
- Le plomb est le 5e niveau dans la progression de la Sarbacane Sportive.
- Le plomb symbolise la lourdeur, l'oppression : Un sommeil de plomb. Un soleil de plomb. Un projet qui a du plomb dans l'aile.
Notes et références
- ↑ EMC-toxicologie Pathologie 2 (2005) 67-88
- ↑ Source : site suisse d'information sur l'eau potable
- ↑ http://www.123-diagnostic.com/dos1-plomb-saturnisme.htm Fiche d'information pour les professionnels
- ↑ EMC-toxicologie Pathologie 2 (2005) 67-88
- ↑ Page consacrée au rapport Poison Kiss de la campagne nord-américaine "'safe cosmetics.
- ↑ Environmental Health persepectives, vol 116, number2, Feb 2008 et Institut de veille sanitaire-intérêt d’une limitation des usages du Pb dans certains produits de consommation-note technique-2007.
- ↑ Le plomb dans l’eau potable.
- ↑ rapport public de synthèse du BRGM
- ↑ Environmental Health persepectives, vol 116, number2, Feb 2008.
- ↑ analytica chimica acta 6 0 0 ( 2 0 0 7 ) 221–225.
- ↑ ECOTO ECOTOXICOLCCY AND ENVIRONMENTAL SAFETY 29, I ?I- I29 ( 1994.
- ↑ Faridah Hussein Were, Wilson Njue, Jane Murungi, Ruth Wanjau, « Use of human nails as bio-indicators of heavy metals environmental exposure among school age children in Kenya », dans Science of The Total Environment, vol. 393, no 2-3, 15 avril 2008, p. 376-384 (ISSN 0048-9697) [texte intégral lien DOI]
- ↑ P.P. Silveira et al psychology and Behavior 2008.
- ↑ Niton Alloy Analyzer - Metal Analysis - Portable Alloy Analyzers
- ↑ M. Sf ölener et al. / Desalination 223 (2008) 308–322
- ↑ Programme De Prevention Contre L'Empoisonnement Par Le Plomb Chez L'Enfant
- ↑ Institut de veille sanitaire-intérêt d’une limitation des usages du Pb dans certains produits de consommation-note technique-2007.
- ↑ Voir London Metal Exchange ou LME: http://www.lme.co.uk
- ↑ Source : Emmanuel Painchault, de la Société générale Asset Management, cité par le journal Le Monde (2007 09 03)
- ↑ Source : envolée de la demande chinoise propulse le plomb à des niveaux records, journal Le Monde (2007 09 03)
- ↑ Pour plus de détails, consulter le site de l'International Lead and Zinc Study Group
- ↑ EMC-toxicologie Pathologie 2 (2005) 67-88
Voir aussi
Bibliographie
- L'histoire secrète du plomb, Jamie Lincoln Kitman, éditions Allia, 2005 (traduction Arnaud Pouillot).
Articles connexes
- Batterie au plomb
- Le plomb est un des éléments principaux dans la fabrication du vitrail au plomb.
- Ion plomb
- Métal lourd
- Munition
- Saturnisme
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cp Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Métal pauvre | Cristallogène | Écotoxicologie | Couverture (construction)
Wikimedia Foundation. 2010.
