- 7727-37-9
-
Diazote
Diazote 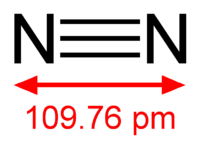
Général Nom IUPAC Diazote No CAS No EINECS No E E941 (E931) SMILES InChI Apparence liquide extrêmement froid, incolore, inodore. ou gaz comprimé incolore, inodore.[1] Propriétés chimiques Formule brute N2 [Isomères] Masse molaire 28,0134 g∙mol-1
N 100 %,Propriétés physiques T° fusion -210 °C[1] T° ébullition -196 °C[1] Solubilité dans l'eau : faible[1],
insol. ds EtOHMasse volumique 0.808kg/l au point d'ébullition du liquide[1] Précautions Transport 20 1066
22 1977 NFPA 704 réfrigéré, liquide cryogénique : [2] SIMDUT[3] 
Unités du SI & CNTP, sauf indication contraire. Le diazote, couramment nommé « azote » de manière incorrecte, est le nom de la molécule diatomique composée de deux atomes d'azote. Elle est notée N2.
Dans les conditions normales de température et de pression, le diazote est un gaz incolore, composant 78% de l'air que nous respirons.
Au XXIe siècle, le diazote est généralement obtenu par liquéfaction de l'air, dont il est le principal constituant avec une concentration de 78,06 % en volume et de 75,5 % en poids.
Sommaire
Production
Le diazote atmosphérique peut être converti en ammoniac grâce au procédé Haber-Bosch. L'ammoniac ainsi produit sert surtout à la fabrication d'engrais[4].
L'extraction du diazote hors de l'air peut entre autres être réalisée au moyen de membranes semi-perméables alimentées en air comprimé. Ces membranes sont composées de faisceaux de fibres d'oxyde polyphénilique creuses à enveloppe perméable enduites d'une couche de 40 nm.
La pureté du diazote produit par une membrane dépend du débit demandé : par exemple, l'obtention d'une pureté de 95% permet des débits allant jusqu'à 5 000 Nm³/h, alors qu'une production d'azote à 99,5% ne permet que 0.5 Nm³/h [5]
Une autre méthode pour produire de diazote à partir d'air comprimé est par adsorption : ce type de générateur d'azote est composé d'un système symétrique de réservoirs remplis d'un tamis moléculaire à base de carbone (CMS). L'air comprimé passe au travers de la colonne « en ligne » et durant ce passage l'O2 et les autres gaz atmosphériques sont adsorbés. Le gaz restant est du diazote prêt à être utilisé. Après un temps préréglé, le cycle s'inverse, la colonne « en ligne » passe en mode régénération pour relibérer les gaz capturés et les relâcher dans l'atmosphère (pureté jusqu'à 10 ppm d'O2[6].
Fixation biologique
Article détaillé : Fixation biologique de l'azote.Plusieurs organismes, comme les champignons et certaines bactéries sont capables de fixer le diazote moléculaire de l'air, première étape avant de pouvoir l'incorporer dans des molécules organiques comme les protéines ou les bases azotées constitutives des acides nucléiques support de l'hérédité comme l'ADN et l'ARN. On rencontre ces champignons en symbiose dans les nodules de légumineuses ; et pour les bactéries, chez les plantes de la famille des fabacées où ils forment des rhizobiums au niveau des racines. C'est un cas de vie symbiotique entre un champignon (ou) une bactérie et des plantes.
Stabilité
Le diazote, caractérisé par la présence d'une liaison covalente triple (une liaison σ et deux liaisons π), est une molécule très stable qui est pour cette raison utilisée comme gaz inerte pour remplacer l'atmosphère dans les synthèses chimiques. Le diazote ne réagit directement qu'avec le lithium et le magnésium pour former les nitrures correspondants Li3N et Mg3N2.
La stabilité de la molécule de diazote est la force motrice, l'origine de l'instabilité, voire de l'explosivité des composés pouvant libérer une molécule de diazote : azotures, sels de diazonium.
Utilisation
- L'azote non liquide est utilisé comme gaz cryogénique.
- On utilise le diazote gazeux pour créer des atmosphères inertes afin de protéger des produits (sodium, aliments, composés organiques, vins par exemple), des objets ou des contenants (citernes) de l'oxydation, de la corrosion, des insectes, des champignons...
- On utilise aussi le azote pour ajuster la composition des mélanges respiratoires dans les caissons de décompression ou les bouteilles de plongée sous-marine.
- Autres usages :
- gaz utilisé comme pesticide doux pour éliminer par asphyxie les vers du bois ou certains organismes (ex : petite vrillette) ayant colonisé des objets anciens fragiles (cadres, sculptures et objets de bois, incunables, les parchemins, gravures, etc.) ;
- gaz de gonflage des accumulateurs hydrauliques en raison de sa passivité vis-à-vis des huiles ;
- agent de lutte contre les incendies : allié à 50% d'argon et parfois avec du dioxyde de carbone, il est présent dans certaines installations d'extinction automatique à gaz protégeant des salles informatiques ou des stockages particuliers ne devant pas être endommagés par de la poudre ou de l'eau. Conservé dans des bonbonnes métalliques sous une pression d'environ 200 bars, il est libéré dans un local où un début d'incendie a été détecté. Le volume de diazote injecté remplace une partie de l'atmosphère de la pièce et entraine une chute du taux d'oxygène dans l'air. Le niveau généralement retenu de 15 % de comburant interrompt le phénomène de combustion sans effet létal sur la respiration humaine ;
- gaz de gonflage de pneumatiques. Bien que l'air contienne déjà 78 % d'azote (de diazote pour être plus précis), certains professionnels de l'aviation ou de la formule 1, (par exemple), augmentent cette proportion et gonflent les pneumatiques avec de l'azote presque pur. Ce gaz, ayant la propriété d'être inerte et stable, conserve une pression plus constante même en cas d'échauffement intense du pneumatique. De plus, il fuit plus difficilement.
Le diazote, contrairement aux gaz inhibiteurs chimiques halogénés et aux CFC ne présente a priori aucun effet nocif pour l'environnement (pas d'impact sur l'effet de serre, ni sur la couche d'ozone). Mais il requiert des réservoirs volumineux, des canalisations adaptées et des mesures constructives pour faire face à la détente brutale d'un équivalent de 40 à 50 % du volume protégé.
Caractéristiques physiques
- Formule chimique : N2
- Masse molaire : 28,0134 u
- Volume molaire : 24,06 L/mol.
- Point d'ébulition sous une pression d'une atmosphère : -195,80 °C
- Point de condensation sous une pression d'une atmosphère : -210,01 °C
- Pression de vapeur saturante à 20 °C : 632 bars (63.2 MPa)
Sécurité
Risque d'asphyxie : le cas le plus fréquemment rencontré est celui de personnes pénétrant dans des réservoirs remplis d'azote, sans s'apercevoir du fait que ce gaz est inodore et ne provoque pas de sensation de suffocation (causée par l'excès de dioxyde de carbone, et non par l'absence d'oxygène). Ces personnes sont alors prises de malaises, perdent connaissance, et, si on ne les retire pas très rapidement de cette situation, succombent. Il est nécessaire de vérifier la présence d'une proportion suffisante d'oxygène dans de tels espaces confinés avant d'y pénétrer, ou de s'équiper d'un appareil respiratoire autonome.
Référence ONU pour le transport de matières dangereuses
- Nom (français) : azote comprimé
-
- Classe : 2
- numéro : 1066
- Nom (français) : azote liquide réfrigéré
-
- Classe : 2
- numéro : 1977
Masse molaire du diazote : 28,0 g⋅mol-1
Notes et références
- ↑ a , b , c , d et e AZOTE (GAZ COMPRIME) et AZOTE (LIQUEFIE), fiches de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultées le 9 mai 2009
- ↑ Office of Radiation, Chemical & Biological Safety (ORCBS). Consulté le 21 avril 2009
- ↑ « Azote » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Voir par exemple (en) Stephen A. Lawrence, Amines. Synthesis, Properties and Applications, Cambridge University Press, 2006, 384 p. (ISBN 978-0521029728), « An introduction to the amines »
- ↑ www.technofluid.be
- ↑ http://www.technofluid.be/ technofluid.be]
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Gaz inorganique | Composé de l'azote
Wikimedia Foundation. 2010.


