- Culicidae
-
 « Moustique » redirige ici. Pour les autres significations, voir Moustique (homonymie).
« Moustique » redirige ici. Pour les autres significations, voir Moustique (homonymie). Moustiques
Moustiques
Aedes (Stegomyia) aegypti Classification Règne Animalia Sous-règne Metazoa Embranchement Arthropoda Sous-embr. Hexapoda Super-classe Protostomia Classe Insecta Sous-classe Pterygota Infra-classe Neoptera Super-ordre Endopterygota Ordre Diptera Sous-ordre Nematocera Infra-ordre Culicomorpha Famille Culicidae
Meigen, 1818
Larves de Culicinae (Culex sp.)

D'autres documents multimédia
sont disponibles sur CommonsLes Culicidae forment une famille d'insectes communément appelés moustiques. Classée dans l'ordre des Diptères et le sous-ordre des Nématocères, cette famille est caractérisée par des individus aux antennes longues et fines à multiples articles, des ailes pourvues d’écailles, et par des femelles possédant de longues pièces buccales en forme de trompe rigide de type piqueur-suceur. À ce jour, 3 523 espèces de moustiques sont inventoriées au niveau mondial mais une bien moins grande proportion pique l'homme.
Les moustiques tiennent un rôle extrêmement important en santé humaine ou animale car ils concentrent, au delà de leur rôle de nuisants par les piqûres douloureuses qu’ils infligent, le plus important groupe de vecteurs d’agents pathogènes transmissibles à l’être humain. Ils sont vecteurs de trois groupes d'agents pathogènes pour l'être humain : Plasmodium, filaires des genres Wuchereria et Brugia, ainsi que de nombreux arbovirus.
Ils sont présents sur l'ensemble des terres émergées de la planète (à l'exception de l'Antarctique), tant dans les milieux forestiers, de savanes ou urbains, dès qu'une surface d'eau douce ou saumâtre, même réduite ou temporaire, est disponible. En France métropolitaine, 47 espèces sont référencées, dont 12 Anopheles.
Morphologie des divers stades de développement
Les moustiques sont des insectes holométaboles passant par 4 phases de développement ; œuf, larve (4 stades larvaires), nymphe et adultes. Les trois premiers sont aquatiques, le dernier aérien. La durée totale de ce développement, fortement influencé par la température, est de 10 à 15 jours pour les zones tropicales du monde qui rassemblent les plus fortes densités d'espèces.
Stade larvaire
Ce stade est aquatique. Les larves de Culicidae se différencient des autres insectes aquatiques par l'absence de pattes. Issue de l'œuf, une larve de premier stade (L1) de taille réduite va, par une succession de trois mues, accroître sa taille, donnant en quelques jours une larve de stade IV (L4), d'une taille, variable selon l'espèce et les conditions de développement, entre 4 et 10 mm. C'est sur ce stade IV que les identifications taxonomiques peuvent être réalisées.
Les larves sont clairement constituées de trois parties :
- une tête pourvue d'une paire d'antennes, d'une paire de mandibules armées de dents sur leur bord distal et qui forment avec le mentum l'appareil masticateur, l'ensemble flanqué d’une paire de brosses buccales qui entraînent les aliments vers cet appareil ; le nombre, la forme, la taille et la disposition des diverses soies céphaliques et antennaires fournissent des renseignements pour l'identification de l'espèce.
- un thorax plus large que la tête comportant le prothorax, le mésothorax et le métathorax, tous trois pourvus de soies ;
- un abdomen pourvu au niveau du huitième segment d'un siphon respiratoire pour la sous-famille des Culicinae. Les espèces de la sous-famille des Anophelinae en sont dépourvues, respirant directement à partir de papilles anales postérieures. Le huitième segment avec son siphon, et le segment X comportant le plus souvent peigne et brosse ventrale, sont également très précieux pour l'identification du genre et de l'espèce.
Stade nymphal
Aquatique, la nymphe présente un céphalothorax fortement sclérifié et renflé avec deux trompettes respiratoires, assez proches l'une de l'autre. Les yeux composés du futur adulte sont visibles latéralement à travers le tégument. Au niveau du céphalothorax se distinguent les ébauches de divers organes du futur adulte : proboscis, pattes, ailes.
L'abdomen se compose de neuf segments, le dernier étant plus petit que les autres, porte à sa partie apicale une paire de palettes natatoires (nageoires), chacune maintenue rigide par une nervure médiane. À l'extrémité de la nervure, la palette porte une soie terminale accompagnée sur la face ventrale d’une soie accessoire. Le bord externe des nageoires porte des dents, variables en grandeur et extension, qui constituent un bon caractère de diagnose. Les caractères des soies de l'angle postero-latéral du huitième segment, ainsi que la soie accessoire sont des caractères particulièrement utilisés. Chacun des huit segments abdominaux porte dorsalement plusieurs paires de soies diverses. Le premier segment porte, en outre, une paire de soies palmées qui contribue à assurer l’équilibre de la nymphe en adhérant par capillarité à la surface de l’eau. La nymphe, également aquatique, ne se nourrit pas mais, durant ce stade (soit 1 à 5 jours), le moustique subit de profondes transformations morphologiques et physiologiques préparant le stade adulte. Au moment de l'exuviation de l'adulte, la pression interne provoque la rupture des téguments du céphalothorax suivant une ligne médio-dorsale. Les bords de la fente s’écartent pour permettre la sortie de l'adulte à la surface de l'eau.
Stade adulte
 Anatomie d'un Culex adulte
Anatomie d'un Culex adulte
Au stade adulte, leur taille varie selon les genres et espèces de 3 à 40 mm mais elle ne dépasse que très rarement les 10 mm, à l'exception des moustiques de la tribu des Toxorhynchitini.
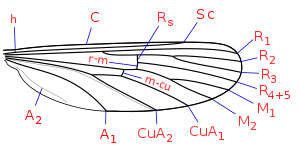
Au stade adulte, les moustiques possèdent, comme tous les Diptères, une seule paire d'ailes membraneuses, longues et étroites, repliées horizontalement au repos. Les Culicidae possèdent un corps mince et des pattes longues et fines. Ils se reconnaissent facilement par la présence d'écailles sur la majeure partie de leur corps. Les femelles possèdent de plus de longues pièces buccales, caractéristiques de la famille, de type piqueur-suceur : la trompe, appelée rostre ou proboscis, qui inflige la douloureuse piqûre si redoutée. Leur tête est pourvue de deux yeux à facettes mais les Culicidae ne possèdent pas d’ocelles.
- Au niveau de la tête, cette famille fait bien partie du sous ordre des Nématocères par ses antennes longues et fines à nombreux articles (15 articles chez le mâle et 14 chez la femelle), dépourvues de style ou d'arista. Les femelles se distinguent facilement des mâles qui sont les seuls à présenter des antennes plumeuses.
- Le thorax des moustiques est formé de 3 segments, avec un segment médian hypertrophié renfermant les muscles des ailes. Ce segment porte les ailes longues et étroites. La nervation des ailes comporte six nervures longitudinales, la 2e, 4e et 5e étant fourchues. Leurs ailes sont diagnostique de la famille en ce qu'elles sont pourvues d’écailles pigmentée qui peuvent former des taches le long des nervures ou le long du bord postérieur. Ces ailes leur permettent de voler en moyenne à 3 km/h[1],[2].
Chaque segment est pourvu d'une paire de pattes longues et fines pourvu d'écailles dont l'ornementation (anneau, bande, moucheture) constitue un caractère d'identification. La répartition des soies et des écailles sur le thorax revêt une grande importance dans la détermination des différents genres et espèces de Culicidae. Citons : les soies acrosticales (sur le « dos » du thorax), les soies pré ou postspiraculaires (avant ou après le spiracle), les soies mésépimérales inférieures et supérieures.
- L'abdomen des moustiques est formé de dix segments dont les deux derniers sont télescopés à l’intérieur du 8e segment : ils sont modifiés en organes reproducteurs. Les premiers segments forment des anneaux emboîtés les uns dans les autres et réunis par une membrane flexible. La partie dorsale (tergite) et la partie ventrale (sternite) de chaque anneau sont réunies latéralement par des membranes souples qui permettent à l'abdomen de se dilater fortement lors du repas de sang. Cette capacité assure également la respiration du moustique par les mouvements de dilatation et de contraction de grande amplitude de l'abdomen, permettant la circulation de l’air au niveau de ses spiracles.
Chez les mâles, les 9e et 10e segments qui forment les génitalia ont une structure d'une assez grande variété. Leurs caractères morphologiques sont très utilisés pour la détermination de l'espèce, par exemple chez les Culex, les Eretmapodites et les Aedes du sous genre Aedimorphus.
Bioécologie des moustiques
Cycle de développement
Les moustiques ont une activité rythmée, saisonnière et nycthémérale.
En vue de l'accouplement, mâles et femelles forment un essaim, peu après le coucher du soleil, à quelques mètres du sol. Ce phénomène est observable pour An. gambiae et An. funestus et il est probable qu'il existe également chez d'autres espèces et d'autres genres. L'accouplement a lieu peu de temps après l’émergence des adultes, chaque femelle étant fécondée une seule fois pour toute sa vie. Le bourdonnement caractéristique des moustiques n'est émis que par les femelles. Il permet aux mâles de les repérer, chaque espèce ayant sa propre fréquence caractéristique[3].
La plupart des moustiques sont hématophages[4], ce repas de sang étant indispensable à la ponte. Elles sont qualifiées d'« endophages » lorsqu'elles piquent à l'intérieur des maisons, d'« exophages » à l'extérieur[5]. Toutefois, les femelles se nourrissent comme les mâles en se gorgeant d'eau sucrée et de sucs végétaux (nectar, sève), et peuvent vivre plusieurs mois (des espèces anthropophiles passent l'hiver en diapause dans des caves, grottes, étables ; d'autres dans des abris en sous-bois), mais alors elles constituent des réserves adipeuses au lieu de pondre.
Phase aquatique : les gites larvaires
Quarante-huit heures après la prise du repas de sang, les femelles fécondées déposent leurs œufs, selon les espèces : à la surface d'eaux permanentes ou temporaires, stagnantes ou courantes, dans des réceptacles naturels ou artificiels ou sur des terres inondables (marécage, rizière…). L'eau est donc absolument nécessaire au développement du moustique. De la boue ou de la terre humide ne conviendront pas[1]. Ces œufs sont pondus soit isolément (Toxorhynchites, Aedes, Anopheles), soit en amas (Culex, Culiseta, Coquillettidia, Uranotaenia) ou bien fixés à un support végétal immergé (Mansonia,Coquillettidia). La fécondité totale d’une femelle varie selon les espèces de 800 à 2 500 œufs (20 à 200 par ponte selon la quantité de sang disponible), plusieurs pontes possibles, généralement une à quatre)[2]. Ces œufs se développent en un à deux jours (selon les conditions météorologiques)[2] et éclosent, donnant naissance à des larves aquatiques de premier stade qui possèdent (à l’exception des Anopheles) au bout de l'abdomen un siphon respiratoire en contact avec l'air. Les gîtes larvaires sont très diversifiés selon les genres et les espèces et comprennent tous les points d'eau possible excepté mers et océans : les eaux courantes (bords de torrents de montagne, de rivières ou fleuves) ou stagnantes (étang, mare, rizière, marécage, bord de rivière, fossé, flaque), ensoleillées (chemin) ou ombragées (en forêt), de grande dimension (lac, fleuve) ou de petite taille (feuille morte), à forte teneur en sels minéraux (eau saumâtre : mangroves, salines) ou chargées de matières organiques (trou d'arbre), les gîtes naturels formés par les végétaux (phytotelmes) : aisselle de feuille, bambou fendu, trou d’arbre, urne de plante carnivore (Nepenthes), champignon creux, feuille à terre, fruit creux), minéraux : flaques, ornières, carrière de briques, empreinte de pas de bétail, trou de crabe, coquille d’escargot, trou de rocher, ou artificiels : citerne, latrine, rejet d’égout, abreuvoir, gouttière, pneu, carcasse de voiture, bidon, bâche, boîte de conserve, pot de fleurs. Chez certains genres (Aedes, Haemagogus, Psorophora), les œufs sont résistants à la dessication, dans l'attente de la remise en eau de leur gîte de ponte.
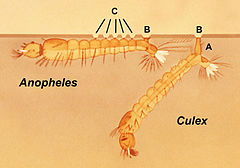 Représentation de la position de la larve des Anophelinae et des Culicinae(ici Culex) à la surface de l'eau. A : siphon respiratoire ; B : papilles annale postérieure ; C : soie palmée. À gauche : Anophelinae ; la larve se maintient à l'horizontale pour respirer à la surface de l'eau. À droite : Culicinae ; la larve se maintient à la verticale pour respirer à la surface de l'eau
Représentation de la position de la larve des Anophelinae et des Culicinae(ici Culex) à la surface de l'eau. A : siphon respiratoire ; B : papilles annale postérieure ; C : soie palmée. À gauche : Anophelinae ; la larve se maintient à l'horizontale pour respirer à la surface de l'eau. À droite : Culicinae ; la larve se maintient à la verticale pour respirer à la surface de l'eau
Les larves s'alimentent et se maintiennent au repos sous la surface de l’eau, respirant par leurs spiracles qui affleurent à la surface et se situent soit directement au niveau du 8e segment abdominal pour les Anopheles (qui doivent donc pour respirer se maintenir parallèles à la surface de l’eau, aidé en cela par des soies spécifiques à cette sous-famille, les soies palmées), soit à l’extrémité du siphon respiratoire du 8e segment pour les Culicinae (qui doivent donc maintenir leur corps oblique par rapport à la surface pour respirer). Enfin, certains genres de Culicinae ont leurs larves immergées, respirant par l'intermédiaire de la tige d'un végétal dans lequel elles insèrent leur siphon (Coquillettidia, Mansonia, quelques espèces du genre Mymomyia). Les larves passent par quatre stades larvaires se traduisant par une augmentation de leur taille, et se métamorphosent en une nymphe.
La nymphe est aquatique et respire l'air atmosphérique au moyen de ces deux trompettes respiratoires. L'extrémité abdominale de la nymphe est aplatie en palettes ou nageoires. Ce stade ne se nourrit pas et est un stade de transition vers l'adulte durant lequel il subit de profonds remaniements physiologiques et morphologiques.
De la nymphe émergera au bout de deux à cinq jours l'adulte volant.
Phase aérienne
La plupart des espèces ont une activité nocturne (genre Culex, Anopheles, Mansonia ) ou bien essentiellement diurne (Toxorhynchites, Tripteroides) à crépusculaire (genre Aedes). En région afrotropicale, la majorité des moustiques se nourrissent la nuit ou au crépuscule, au moins en zone de savanes et à basse altitude ; en montagne, où il fait très froid la nuit, et en forêt dense, où règne en permanence une mi-obscurité, un certain nombre d'espèces ailleurs nocturnes ou crépusculaires attaquent couramment de jour. Chaque espèce de moustique semble posséder, dans des conditions climatologiques déterminées, un cycle d'activité qui lui est propre. Chez le genre Anopheles, la durée du stade larvaire est d'environ sept jours (si les conditions extérieures sont favorables : qualité de l'eau, température et nourriture essentiellement). Les adultes vivent selon les conditions et les espèces de 15 à 40 jours, excepté pour certaines espèces dont les femelles peuvent hiverner.
Les mâles se déplacent assez peu du gîte dont ils sont issus, et leur longévité est relativement faible. La femelle peut migrer jusqu’à 100 km de son lieu de naissance (transport passif par le vent). Dans les zones tempérées, à l'arrivée de l'hiver, certaines espèces peuvent hiverner au stade adulte, d'autres laissent leurs larves perpétuer seules l'espèce à l'arrivée du printemps[6]. L'espérance de vie peut varier de deux à trois semaines pour certaines espèces, à plusieurs mois pour d'autres[7]. En état de diapause, l'espérance de vie de certains moustiques peut atteindre plusieurs mois (selon l'espèce).
Prélèvement de sang par piqûre
 Le moustique Aedes (Stegomyia) aegypti lors d'une piqûre. Noter la dilatation de l'abdomen, gorgé de sang.
Le moustique Aedes (Stegomyia) aegypti lors d'une piqûre. Noter la dilatation de l'abdomen, gorgé de sang.
Pour les espèces hématophages, l'alimentation en sang est nécessaire à la ponte. La séquence (repas sanguin, maturation des œufs et ponte) est répétée plusieurs fois au cours de la vie du moustique, et s'appelle le cycle gonotrophique. La durée de ce cycle dépend de l'espèce, mais surtout de la température externe (par exemple, chez A. gambiae, le cycle dure 48 heures lorsque la moyenne de température jour/nuit est de 23 °C). La piqûre, le plus souvent nocturne (et plus particulièrement à l'aube ou au crépuscule), dure deux à trois minutes si le moustique n'est pas dérangé.
La femelle adulte, pour sa reproduction, pique les animaux pour prélever leur sang, qui contient les protéines nécessaires à la maturation des œufs (notamment le vitellus destiné à nourrir le germe de l'œuf[8]).
Pendant la piqûre, la femelle injecte de la salive anticoagulante (sur la photo ci-contre, une femelle du genre Aedes, dont l'estomac est gorgé de sang) qui, chez l'Homme, provoque une réaction allergique inflammatoire plus ou moins importante selon les individus : c'est la formation d'un « bouton » qui démange.
L’être humain n’est pas la principale victime des moustiques, loin de là : plus de la moitié des espèces se nourrissent exclusivement du sang des oiseaux, suivi de celui des rongeurs et des grands mammifères, des reptiles et batraciens.
Techniques de chasse de la femelle
Tout comme la tique, le moustique repère sa cible grâce à son odorat : celui-ci leur révèle d'abord la présence de dioxyde de carbone (émis par la respiration et la transpiration) jusqu'à 30 m[9], puis d'acides gras comme l'acide butyrique ou l'acide lactique, et de substances aux relents ammoniaqués, émis par la sudation de la peau (c'est l'un des facteurs qui explique que certaines personnes sont plus souvent piquées que d'autres). Des scientifiques américains ont identifié plus de 340 odeurs émises par la peau humaine susceptibles d'attirer les moustiques. Des thermorécepteurs leur permettront ensuite de trouver la veinule qui leur permettra de s'alimenter[1],[4].
Les espèces anthropophiles sont spécialement sensibles aux kairomones comme l'acide lactique ou le sébum, ou aux nombreuses odeurs comme l'ammoniac, l'acide lactique, l'aminobutane) émises par la sueur ou l'haleine[10], l'odeur propre de la peau, l'urine[11], les vapeurs d'alcool ou de parfum et bien d'autres encore (par exemple l'odeur d'une personne ayant consommé de la bière ou du fromage[12]). Les moustiques sont également sensibles à la chaleur (15 à 30 °C) et l'humidité (en pratique plutôt l'été et par temps orageux, donc), et seront plus attirés par une personne avec une température élevée[13],[4]. Ils repèrent les veinules qu'ils piquent grâce à leurs thermorécepteurs[9]. Les moustiques sont également attirés par certaines couleurs. La croyance couramment répandue que les moustiques sont sensibles à la quantité de sucre dans le sang serait par contre fausse[4].
De même que d'autres insectes, les moustiques peuvent détecter ces émanations depuis de longues distances (± 20 m pour le CO2). Les femelles sont immédiatement attirées par ces sources alors qu'elles sont répulsives pour les mâles. De même, les substances attractives ou répulsives peuvent varier d'une espèce à l'autre. Les moustiques sont encore sensibles à de nombreux autres paramètres (comme par exemple, la hauteur à laquelle l'odeur est perçue, dans le cas d'An.gambiae, qui vole au ras du sol et pique de préférence les pieds et les chevilles[14]). Pour repérer leurs proies, les femelles volent de-ci de-là (maximum 2 km) en utilisant leurs capteurs pour détecter, en premier lieu, les kairomones, ensuite le CO2, et enfin la température relative et les facteurs visuels (le système visuel, sensible à la lumière, aux mouvements (par les vibrations de l'air qu'ils produisent, auxquelles les moustiques sont très sensibles) et aux couleurs, est peu performant, et n'interviendraient qu'à partir de moins de 1,5 m[15]). La légende tenace qui veut que l'on éteigne la lumière pour ne pas attirer les moustiques est donc fausse[16].
Alimentation
Un moustique femelle du genre Aedes s'alimentant du nectar des fleurs de Tanacetum vulgare avec sa trompe.
Alimentation des adultes : Les adultes, tant mâles que femelles, sont avant tout nectarivores, s'alimentant de nectar et du jus sucré des fleurs ou des fruits mûrs pour couvrir leurs besoins énergétiques. En élevage (dans les laboratoires d'entomologie médicale), il leur est ainsi fourni des tampons de coton imbibés d'eau sucrée, qui suffisent à leur survie, sans avoir recours à une alimentation sanguine.
En outre, les femelles (à l'exception des espèces du genre Toxorhynchites), à seule fin d'assurer le développement de leurs œufs, ont recours à des repas de sang sur des vertébrés divers à sang chaud (oiseaux, mammifères dont l'homme) ou à sang froid comme les batraciens (grenouille, crapaud), les reptiles (serpent, tortue) ou même d'autres insectes (larves de Lépidoptères, nymphes de cicadelle, mantes). Traversant la peau jusqu'à un vaisseau, elles effectuent une prise de sang. Chaque espèce a sa propre spécificité plus ou moins affirmée dans le choix de l'hôte pour ce repas de sang. Ainsi, Culex hortensis et Culex impudicus piquent de préférence les batraciens, Cusileta longiareolata et le genre Aedeomyia les oiseaux, alors que Anopheles gambiae, que Aedes albopictus, Aedes caspius, Aedes vexans ou Culex pipiens, Culex quinquefasciatus, préfèrent l’Homme. On parle de moustique anthropophile s'il pique préférentiellement l'homme ou zoophile s'il pique préférentiellement d'autres vertébrés.
Alimentation des larves : Les larves de moustiques ont pour la plupart une alimentation constituée de phytoplancton, de bactérioplancton, d'algues microscopiques et de particules de matière organique en suspension dans l'eau du gîte. La larve s'alimente grâce aux battements de ses soies buccales qui créent un courant suffisant pour aspirer les aliments.
D'autres espèces sont prédatrices au stade larvaire, se nourrissant essentiellement de larves de Culicidae divers. Ce type de comportement alimentaire est assez rare parmi les Culicidae, ne se rencontrant que pour l'ensemble des espèces des genres Toxorhynchites, Psorophora et Lutzia, chez les Aedes du sous-genre Mucidus, les Tripteroides du sous-genre Rachisoura et chez des espèces des genres Sabethes, Eretmapodites (Er. dracaenae, prédateur des larves d'Aedes simpsoni (Pajot 1975)) et Culiseta. Elles sont pour la plupart reconnaissables à leur brosse buccale souvent modifiée en épines préhensibles fortes et recourbées vers le bas.
Prédateurs
Les larves et les nymphes de moustiques sont consommées par des oiseaux aquatiques, batraciens (tritons, grenouilles, crapauds, salamandres), poissons (tels, par exemple, la gambusie), insectes (Chaoboridae, Notonectes, coléoptères, libellules…)[17], des crustacés (Copepoda Cyclopoida tel que Mesocyclops aspericornis), des plantes carnivores (l'aquatique utriculaire, le drosera)[18] ou encore le nématode Romanomermis culicivorax[19], etc.
D'autres espèces se nourrissent de moustiques adultes : les araignées[20], certaines espèces de poissons comme l'épinoche, de libellules, de chauves-souris ou d'oiseaux[21], comme l'hirondelle ou l'engoulevent[19],[22], etc.
Contribution des moustiques au fonctionnement des écosystèmes
Les adultes mâles et femelles se nourrissant de nectar de fleurs, ils participent à la pollinisation des plantes, au même titre que les papillons, Hyménoptères et autres Diptères[23].
D'autre part, les moustiques, tant au stade larvaire qu'adulte, sont une source de nourriture pour de nombreux prédateurs (insectes, lézards et même oiseaux), transférant de l'eau à la terre d'importantes quantités de biomasse[23],[3]. Cependant, ces espèces se développant en grande quantité par phases cycliques, elles ne peuvent être à la base d'une chaîne alimentaire, et le moustique est donc utile, joue un rôle important mais n'est indispensable dans aucune chaîne alimentaire, et supprimer le moustique ne ferait pas disparaître de prédateur[1].
De plus, certaines larves, représentant une part importante de la biomasse[Combien ?] des écosystèmes aquatiques, filtrent jusqu'à deux litres par jour en se nourrissant de micro-organismes et déchets organiques[2]. Elles participent donc de façon importante à la bioépuration des eaux marécageuses[23] et, par leur mort ou leurs déjections, rendent des éléments indispensables à la croissance des plantes, tel l'azote[23].
Les espèces de moustiques vecteurs de maladies évoluent déjà en milieu urbain, et ne sont donc pas utiles à la pollinisation ou à l'épuration des eaux. Intervenir sur ces espèces-là ne fait donc pas peser de risques sur les écosystèmes[1].
En Arctique, les caribous empruntent des chemins face au vent pour échapper aux essaims de moustiques. Sur ce chemin de migration, ces caribous tassent le sol et broutent le lichen, ce qui altère l'écosystème boréal[23].
Importance médicale
Rôle nuisant
La piqûre et son traitement
La trompe (proboscis) de la femelle est composée par des pièces buccales vulnérantes ou stylets (maxilles, labre, hypopharynx) qui sont enveloppées par le labium souple (i) qui se replie au moment de la piqûre.
Le moustique enfonce les stylets dans l’épiderme jusqu’à un capillaire sanguin grâce aux maxilles qui perforent la peau et qui permettent à la trompe de se maintenir en place lors du prélèvement sanguin.
Les stylets délimitent deux canaux : l’un (canal salivaire), formé par l’hypopharynx, par lequel est injectée une salive anesthésiante et anticoagulante, l’autre (canal alimentaire), au niveau du labre, par lequel est aspiré le sang qui, s’il est infecté, contamine le moustique.
La quantité de sang prélevée varie de 4 à 10 millimètres cubes en 1 à 2 minutes[24].
Les piqûres peuvent être totalement indolores ou provoquer un prurit très désagréable ou des allergies plus graves, allant exceptionnellement jusqu'au choc anaphylactique. L’hypersensibilité a une origine immunitaire, qui traduit une réaction extrême de nos anticorps à des antigènes présents dans la salive du moustique.
Certains de ces antigènes sensibilisants existent chez tous les moustiques, tandis que d'autres sont spécifiques à certaines espèces. La réaction d'hypersensibilité peut être immédiate (types I et III) ou retardée (type IV)[25].
Divers remèdes sont plus ou moins efficaces selon les personnes et les délais d'application. Outre le vinaigre au peroxyde de zinc, dont l'effet calmant n'est pas médicalement prouvé, et des produits interdits en raison de leur toxicité, quelques médicaments existent ; antihistaminiques oraux ou topiques appliqués et diphénhydramine (Benadryl en onguent), qui semblent soulager efficacement les démangeaisons. Les corticostéroïdes topiques tels que l'hydrocortisone et la triamcinolone peuvent soulager, dans le cas de piqûres inopportunément placées. On attribue également un effet calmant au savon de Marseille (frotter à l'endroit de la piqûre). On peut aussi poser un objet chaud (tasse de thé brûlant, par exemple) quelques secondes sur la piqûre, ou la tamponner avec un glaçon. On cite aussi le déo rollon et la crème anti-hémorroïdes[26].
On a cité l'application directe d'un tissu imbibé d'eau très chaude mais non bouillante pour bloquer (pour quelques heures) le dégagement d'histamine autour de la piqûre. L'application d'un Mylanta ou d'un antiacide liquide serait selon certains auteurs efficace en soulageant le prurit et le gonflement car réduisant l'acidité des anticoagulants injectés avec la salive de l'insecte.
Rôle vectoriel
Les Culicidae constituent le tout premier groupe d'insectes d'intérêt médical. Les moustiques sont vecteurs de trois groupes d'agents pathogènes pour l'être humain : Plasmodium, filaires des genres Wuchereria et Brugia, ainsi que de nombreux arbovirus.
Plus de 150 espèces de Culicidae relevant de 14 genres ont été observées porteuses de virus impliqués dans des maladies humaines (Mattingly, 1971). C'est par sa trompe qui lui sert à piquer que le moustique transmet les pathogènes à l'être humain ou aux animaux.
Les moustiques sont responsables de la transmission du paludisme, une des toutes premières causes de mortalité humaine (chaque année, entre 250 et 600 millions de personnes touchées dans le monde, et plus d'un million de morts[27],[28],[29]), de nombreuses maladies à virus (arboviroses) telles que la dengue, la fièvre jaune, la fièvre de la vallée du Rift, la fièvre du Nil occidental (West Nile Virus), le chikungunya, d’encéphalites virales diverses ainsi que de filarioses et constituent à ce titre l’un des sujets majeurs d’études en entomologie médicale.
Lors de la piqûre d'un hôte porteur d'un parasite, le moustique aspire, en même temps que le sang, le parasite pathogène (excepté les filaires, virus de la dengue, de la fièvre jaune, le virus du Nil occidental ou le virus du chikungunya…), qui parvient ensuite dans l'estomac du moustique, puis franchit la paroi stomacale. Une fois multiplié, il se retrouve dans les glandes salivaires du moustique qui l'inocule à son hôte lors de la piqûre, par la salive infectée, via l’hypopharynx.
Les genres Anopheles (paludisme), Aedes (dengue et fièvre jaune également), Culex (fièvre du Nil occidental et diverses encéphalites) ainsi que des Eretmapodites (fièvre de la vallée du Rift) et Mansonia (filarioses) contiennent la majorité des espèces vectrices qui contaminent l'homme[30].
Les moustiques vecteurs de maladies graves sont surtout présents dans les pays du Sud (notamment Afrique, Sud de l'Asie, Amérique latine). Mais les déplacements de personnes et de marchandises, combinés au changement climatique, permettent aux espèces incriminées (par exemple le moustique tigre et l'Aedes japonicus) d'étendre leur territoire toujours plus au Nord, amenant avec elles des maladies jusqu'alors absentes ou disparues (le paludisme ayant été éradiqué de l'Europe au vingtième siècle)[30]. Ainsi, de nombreux cas de chikungunya, virus véhiculé par certains Aedes, et notamment le moustique tigre, sont apparus en 2007 en Vénétie. Le moustique tigre, déjà présent en Italie ou dans le sud de la France en 2010, pourrait avoir colonisé l'ensemble de l'Europe d'ici 2030[31].
Principales maladies transmises à l'homme par les moustiques
- Paludisme
- Fièvre de la vallée du Rift
- Fièvre jaune
- Chikungunya
- Virus du Nil occidental : en Europe, ce virus a été isolé des espèces Culex pipiens, Cx. modestus, Mansonia richiardii, Aedes cantans, Ae. caspius, Ae. excrucians, Ae. vexans, et d'une anophèle du complexe maculipennis (Hubálek, 2007)
- Dengue
- Filarioses
- Encéphalites
Il est important de noter que le sida ne fait pas partie de ces maladies transmissibles par le moustique, pour plusieurs raisons[28], notamment que le virus du sida n'est pas capable de se reproduire dans le moustique et de parvenir dans ses glandes salivaires. Le virus du sida, digéré avec le sang en moins de 24 heures et détruit, ne survit pas sur le moustique[28],[1].
Filarioses lymphatiques
Article détaillé : Filariose.Plus de 40 espèces de Culicidae, relevant de 4 genres, sont impliquées dans la transmission des filarioses lymphatiques. Ce sont des infections parasitaires engendrées par trois espèces de filaires : Wuchereria bancrofti, la plus fréquente et sa variété pacifica, Brugia malayi et Brugia timori.
La filariose de Bancroft à Wuchereria bancrofti sévit dans toute la zone intertropicale (Caraïbes, Amérique latine, Afrique, Inde, Asie du Sud-Est et les îles du Pacifique). La variété pacifica sévit en Océanie.
La filariose de Malaisie (ou filariose lymphatique orientale) due à Brugia malayi, est exclusivement asiatique (Asie du Sud-Est, Inde, Sri Lanka, Corée et Chine). Brugia timori ou filaire de Timor sévit dans les îles du Sud-Est de l'Indonésie (Timor).
Des moustiques des genres Culex (en particulier Culex quinquefasciatus), Anopheles (Anopheles gambiae, An. funestus) et Aedes (Aedes polynesiensis) sont vecteurs des 2 types de filarioses.
En Afrique, W. bancrofti est transmis par Cx. quinquefasciatus et, en Afrique centrale et occidentale, uniquement par des Anopheles : An. funestus, An. Complexe gambiae.
De plus, des espèces du genre Mansonia transmettent la filariose de Malaisie (Brugia malayi). Des espèces vivant dans des marécages ouverts (Mansonia uniformis, Ma. annulifera, Ma. indiana) sont vectrices de l’Inde jusqu’en Asie de l’est. Des espèces zoophiles et rurales, Ma. bonneae, Ma. dives et Ma. uniformis sont vectrices en Thaïlande, Malaisie et aux Philippines. Des espèces du genre Coquillettidia sont signalées vectrices en Indonésie.
Wuchereria bancrofti pacifica présente dans les îles du Pacifique sud est transmise majoritairement par Aedes (Stegomyia) polynesiensis, Ae. (Stegomyia) pseudoscutellaris, Ae. (Stegomyia) tongae, Ae. (Stegomyia) hebridea ainsi que par Ae. (Ochlerotatus) vigilax, espèce de Mangrove très agressive envers l’être humain. Brugia timori est transmise par Anopheles barbirostris.
Le cycle est indirect et fait intervenir l'être humain comme hôte définitif et un moustique comme hôte intermédiaire. Les microfilaires (larve de 1er stade) sont absorbées par le moustique lors d'un repas de sang chez un hôte infesté. Dans les 12 heures, elles traversent la paroi stomacale et gagnent la musculature thoracique du moustique. Là, après deux mues, elles se transforment en une dizaine de jours en formes infectantes. Enfin, les larves de troisième stade migrent vers le labium et sont inoculées à l’hôte lors d’un nouveau repas de sang du moustique, pénétrant activement par la blessure créée par la piqure. Le parasite ne subit aucune multiplication chez le vecteur.
La forte présence de microfilaires au niveau des muscles thoraciques du Culicidae entraîne chez ce dernier une diminution de sa capacité de vol.
Les filarioses lymphatiques touchent 120 millions de personnes dans 83 pays d'Afrique, d'Amérique latine et d'Asie et 40 millions d’entre elles souffrent de difformités et d'invalidités graves. Près d’un tiers des porteurs de la maladie vivent en Inde, un autre tiers en Afrique, tandis que le dernier tiers se répartit entre l’Asie du Sud-Est, le Pacifique occidental et l’Amérique latine.
Encéphalites
Article détaillé : Encéphalite.- Encéphalite de Saint Louis : Cette encéphalite doit son nom à l'importante épidémie qui se déclara en 1933 dans la ville de Saint-Louis (États-Unis) au cours d'une sécheresse exceptionnelle. Ces conditions climatiques associées à une forte insalubrité favorisèrent le développement de Culex quinquefasciatus, moustique vecteur de cette encéphalite due à un arbovirus (Flavivirus). Moins de 1 % des infections sont symptomatiques avec un taux de mortalité variant de 5 à 20 % affectant avant tout les personnes âgées. Cette encéphalite est présente sur le continent américain, du Canada jusqu’au sud de l’Argentine. En 2005, une épidémie a été observée en Argentine avec 47 cas dont 9 décès, et 40 cas en 2010.
- Encéphalite de la Murray Valley : dénommée parfois encéphalite australienne, elle a été signalée pour la première fois en 1951 dans la vallée de la rivière Murray en Australie. Elle a été retrouvée depuis dans certaines régions de l'Australie (Province de Victoria en 2008) et de la Nouvelle Guinée. Elle est due à un virus de la famille des Flaviviridae, transmis principalement par des espèces du genre Culex, en particulier Culex (Culex) annulirostris et par Aedes (Stegomyia) aegypti (transmission transovarienne). Le réservoir principal est constitué par les oiseaux aquatiques de l'ordre des Ciconiiformes (hérons et cormorans). Il n'existe pas de traitement efficace, ni de vaccin, mais elle ne se transmet pas d'homme à homme. Si la mortalité atteint 25% des formes symptomatiques, cette encéphalite n'a toutefois entraîné que 32 décès depuis 1951.
- Encéphalite japonaise : Les Culex, principalement Culex (Culex) tritaeniorhynchus et dans une moindre mesure Culex annulus, Culex gelidus, Culex fuscocephala et le complexe Culex vishnui, sont les vecteurs de l'encéphalite japonaise. Ces espèces sont normalement zoophiles, mais s'attaquent à l'être humain lors de fortes pullulations. Aedes japonicus est également cité comme espèce vectrice et peut transmettre le virus à sa descendance (transmission transovarienne) (Takashima & Rosen, 1989).
Une transmission verticale des virus (transovarienne) des encéphalites japonaise et de St. Louis par Aedes albopictus est possible (Rosen, 1988).
Cette maladie virale (Flavivirus) est endémique dans le Sud-Est de l'Inde et au Sud-Est asiatique (Malaisie, Thaïlande, Viêt Nam, Philippines, Indonésie). Elle est épidémique en Chine (partie), en Corée ainsi que dans certaines régions d'Océanie, au nord de l'Australie et au Japon. L'encéphalite japonaise est une cause majeure d'encéphalite virale avec 30 000 à 50 000 cas cliniques signalés chaque année, provoquant 15 000 décès.
Les zones touchées sont essentiellement les zones rurales où les moustiques pullulent dans les rizières et zones inondées avec une forte activité crépusculaire et nocturne, infligeant alors à l'être humain et aux animaux domestiques des piqûres douloureuses. L'être humain n'est qu'un hôte accidentel du virus, favorisé en cela par la création de rizières et de porcheries à proximité d'habitations humaines. Le réservoir de base du virus est constitué par les oiseaux Ardeidae (hérons et aigrettes) et des canards vivant dans les zones humides, et pour réservoir relais les animaux domestiques (porcs principalement). Les chevaux, les chauves-souris et les reptiles sont également cités comme hôtes.
Il n’y a pas de transmission inter-humaine. Il existe un vaccin efficace contre cette maladie.
Contrôle des moustiques
L'homme cherche depuis longtemps à lutter contre les moustiques, causes de démangeaisons et vecteurs de maladies. Il existe des méthodes passives ou actives, biologiques ou chimiques, adaptées au stade de développement de ces insectes. En France, ceci est régulé par la loi n° 64-1246 du 16 décembre 1964 « relative à la lutte contre les moustiques ».
Lutte au stade larvaire
Aux stades œuf, larve et nymphe, les moustiques prolifèrent dans l'eau, qu'elle soit stagnante ou courante, temporaire ou permanente. L'eau est absolument nécessaire au moustique (de la boue ou de la terre humide ne conviendront pas)[1].
Lutte à grande échelle
Dans les régions fortement infestées, comme les régions marécageuses, des larvicides sont utilisés à grande échelle pour limiter la prolifération des moustiques. Les larves devenant progressivement résistantes à un produit, les chercheurs doivent sans cesse mettre au point de nouvelles formules de pesticides ou biopesticides[32],[33].
La lutte à grande échelle passe aussi par l'aménagement du territoire pour limiter les gites de ponte : drainage, collecte des eaux usées, goudronnage des routes, élimination des décharges sauvages et des stockages à ciel ouvert. C'est notamment la méthode préconisée pour éviter la propagation des espèces comme Aedes albopictus, responsables du chikungunya, transportées d'un pays à l'autre dans des stocks de vieux pneus[34].
Dans leur aire de répartition, c'est-à-dire principalement les zones tropicales et subtropicales, on pratique une lutte biologique en relachant dans la nature des larves de Toxorhynchites, des grands moustiques qui ne piquent pas les vertébrés mais dont les larves se nourrissent de larves de Culicidés. Cette méthode obtient un succès variable selon les pays ou les espèces visées[35],[36].
Protéger les populations de prédateurs des larves de moustiques, tels que tritons, grenouilles, crapaud, salamandres… permet aussi d'éviter leur prolifération.
Lutte par la destruction des gites domestiques
Pour éviter d'être envahi par les moustiques dans les zones urbaines le plus simple consiste à éliminer au maximum tout réservoir potentiel d'eau stagnante où des moustiques pourraient pondre et des larves se développer, même de faible volume, par un entretien de son environnement proche. Ainsi les autorités sanitaires recommandent une surveillance de l'environnement proche des habitations et la suppression des récipients susceptibles de collecter de l'eau (soucoupes de pot de fleur, vases, bidons, bâches, gouttières, poubelles à ciel ouvert, brouettes…)
Une technique plus élaborée consiste, après avoir supprimé tous les autres points d'eau dans les environs, à offrir des gîtes pièges (récipients d'eau de pluie stagnante) où la ponte des femelles pourra être contrôlée. Lorsque les larves commencent à être assez grosses et bien visibles, et avant qu'elles ne se nymphosent (soit environ tous les cinq jours), l'eau est vidée dans la terre, en veillant à ce qu'elle soit complètement absorbée. Les larves, privées d'eau, dépérissent.
Pour les récipients impossibles à vider (puisards, puits, latrines, collecteurs d'eau de pluie ouverts…), il importe qu'ils soient couverts hermétiquement ou avec de la toile moustiquaire ou, à défaut, de recouvrir cette eau d'une fine couche d'huile : les larves ne peuvent plus respirer et meurent. Il est aussi possible de laisser du cuivre dans le récipient, ce qui tue les larves ou ralentit leur développement[37].
Lutte au stade adulte
De nombreuses méthodes sont réputées pour éviter d'être piqué par les moustiques, dont certaines sont inefficaces, peu efficaces ou sans efficacité prouvée. Certaines méthodes efficaces ont des effets négatifs à long terme. Pour se prémunir des piqûres dans les régions fortement infestées, il faut combiner les moyens de protection et parfois de lutte.
Se protéger physiquement
Comportement
La plupart des espèces de moustiques sont les plus actives à la tombée du jour, donc il convient de tenir compte des horaires afin de ne pas s'exposer inutilement. Les mouvements attirent les moustiques. La femelle moustique est attirée par une température entre 18° et 30°, la transpiration : l'humidité ainsi que l'odeur de celle-ci, accentuée par certains aliments (bière, fromages…)[9] ou le CO2 émis par l'hôte à piquer[38]. Certains médicaments comme les stéroïdes ou les médicaments anti-cholestérol attirent aussi les moustiques[26], ainsi que les parfums[38].
Habillement
Aux époques, lieux et heures où sortent les moustiques femelles, il est recommandé avant tout de porter des vêtements longs et couvrant tout le corps, amples car les moustiques peuvent piquer à travers des vêtements serrés et de couleur claire car beaucoup d'espèces de moustiques sont attirées par les couleurs foncées[37],[38].
Moustiquaire imprégnée
La toile moustiquaire peut équiper les portes et les fenêtres, entourer les lits, berceaux ou poussettes d'enfant et même protéger le visage dans les zones fortement infestées. Elle sert aussi à empêcher les femelles de pondre dans les réserves d'eau.
La méthode de lutte donnant le meilleur résultat, notamment contre le paludisme, est l'utilisation de toile moustiquaire imprégnée d'insecticide. En 1983, au Burkina Faso, une première association insecticide-moustiquaire fut mise en place par imprégnation de moustiquaires dans la ville de Bobo-Dioulasso. Ces moustiquaires se sont avérées particulièrement efficaces contre les anophèles en termes de mortalité des moustiques et de réduction du taux de piqûres. Globalement, la moustiquaire imprégnée réduit de 36 % le taux de piqûres des moustiques par rapport à une moustiquaire non traitée et tue de l’ordre de 37 % des moustiques présents. La généralisation de leur emploi pourrait réduire de moitié environ l'impact du paludisme et de 20 % la mortalité infantile[39].
Utiliser des répulsifs
Dans les zones infestées, la peau, mais aussi les vêtements, peuvent être imprégnés d'un répulsif à insectes. En fonction du type de peau, le pharmacien peut recommander un répulsif particulier. Lors de voyages, mieux vaut acheter sur place, les produits seront plus adaptés aux moustiques locaux[40].
L’Organisation mondiale de la Santé (OMS) recommande principalement ceux qui renferment du DEET (N,N-diéthyl-3-méthylbenzamide, auparavant appelé N,N-diéthyl-m-toluamide), de l'IR3535 (éthyl butylacétylaminopropionate) ou de l'icaridine (1-piperidinecarboxylic acid, 2-(2-hydroxyethyl)- 1-méthylpropylester)[41].
Le répulsif le plus efficace est le DEET, mais de récentes études montrent une possible toxicité chez l'homme, en particulier pour les femmes enceintes et les enfants[42]. On a recensé dans le monde douze cas de convulsions chez l'enfant depuis la mise en œuvre de ce produit, sans que l'origine de ces convulsions puisse être imputée au produit ; il s'agit donc là d'un principe de précaution que certains jugent abusif[réf. nécessaire].Les répulsifs à base d'huile de haricot de soja et d'IR3535 présentent une protection de plus courte durée[réf. nécessaire].
Les autres répulsifs d'origine végétale, dont l'essence de citronnelle, ont une durée d'effet très courte et sont donc considérés comme inefficaces à l'extérieur. Selon l’OMS, les vaporisateurs, à la citronnelle par exemple, « peuvent aussi réduire les piqûres à l’intérieur des bâtiments[41] ».
La culture, par exemple au rebord des fenêtres, de certaines plantes (citronnelle, lamiacées (labiées) tels que la mélisse, le thym, le thym citron, le romarin, la lavande, le basilic, le basilic à petites feuilles, les géraniacées tels que les geranium, en particulier le geranium citron, et pelargonium, pyrèthre, les plants de tomates, les capucines), aurait un effet répulsif[37].
Selon certains récits de vie à l'écart de la civilisation, la salive mélangée à du tabac pourrait être efficace. La nicotine est effectivement un excellent insecticide naturel. Le feu et la fumée éloigneraient aussi les moustiques, mais non sans conséquences pour la santé des humains qui respirent cette fumée[réf. nécessaire].
Les bracelets anti-moustiques sont quasiment inopérants[40],[43]. De même, les appareils anti-moustiques électroniques, censés éloigner les moustiques par émission d'ultrasons, sont en réalité inefficaces, la femelle étant insensible à ces vibrations[38],[44],[45],[1],[40],[46].
Lutter contre les moustiques
Des aérosols et diffuseurs d'insecticide sont commercialisés mais ils ne présentent d'intérêt que dans une pièce fermée. Ils présentent alors d'autres risques avérés ou potentiels pour la santé des occupants qui les respirent, notamment les enfants[47] . De plus, les insecticides sélectionnent rapidement des résistances à leur efficacité chez la plupart des espèces de moustiques visées.
Selon l’OMS, les spirales anti-moustiques et autres vaporisateurs « peuvent aussi réduire les piqûres à l’intérieur des bâtiments[41] ».La résistance de nombreuses souches de moustiques à certains pesticides a rapidement et fortement augmenté (beaucoup plus vite que pour les résistances des plantes aux désherbants)[48]. À titre d'exemple, une résistance (génétiquement héritable pour la descendance) au DDT a été constatée chez les moustiques dès 1947 en Floride, un an seulement après les premières utilisations du DDT (Hemingway et Ranson 2000)[49],[50],[51].
Des indices laissent penser que la présence d'insecticides dans le milieu aquatique où se développement les larves s'accumulent dans les tissus larvaires et donc de l'adulte, entrainant peut-être « le maintien de l‟induction de certaines enzymes de détoxication et par conséquence le maintien de l‟augmentation de tolérance à l‟insecticide »[48]. On constate en tous cas que « les moustiques issus de zones agricoles ou plus généralement polluées par des composés organiques tolèrent mieux les insecticides »[48],[52],[53],[54],[55]), ce qui n'exclut pas des phénomènes de résistance croisée avec divers pesticides utilisés en agriculture, en médecine vétérinaire, ou ayant été utilisés, mais persistants et donc encore présent dans l’environnement des larves.
Ces adaptations posent des problèmes de lutte contre les maladies véhiculées par les moustiques (malaria...), et pourraient continuer à augmenter, alors que les populations de moustiques indésirables pourraient s'étendre à la faveur du réchauffement climatique et de la mondialisation des échanges.Pour répondre à ces adaptations, outre l'utilisation de cocktails d'insecticides et le changement régulier de molécules, une autre stratégie consiste à ne pas encourager les milieux favorables aux moustiques piqueurs (eaux stagnantes) et à favoriser le développement de prédateurs naturels des moustiques, par exemple en protégeant les poissons et insectes aquatiques mangeurs de larves de moustiques et en offrant des nichoirs aux chauves-souris et aux hirondelles pour lutter contre le moustique commun. Cependant ces stratégies sont insuffisamment efficaces[19].
En revanche, les électrocuteurs d'insectes utilisant une lumière blanche, bleue ou ultraviolette pour les attirer, n'ont pas d'efficacité sur les moustiques qui sont attirés par l'odeur des mammifères et en aucun cas par la lumière[38],[56],[40],[40], argument qui peut être discuté, car les moustiques ne sont pas attirés par le CO2 émis par les cheminées, gazinières, etc. Il pourrait être sensible à certaines molécules émises par le corps humain et transportées par l'air.
Taxonomie
En 1759, Carl von Linné désigne sous le genre Culex les quelques moustiques – et assimilés – connus de l'époque. Meigen, en 1818, redistribue ce genre en trois genres selon le critère morphologique de la longueur des palpes : genre Anopheles pour les moustiques à palpes longs pour les deux sexes, Culex avec les palpes longs pour les mâles et courts pour les femelles et Aedes aux palpes courts pour les deux sexes. Entre 1828 et 1896, au fil des nouvelles découvertes, les entomologistes Robineau-Desvoidy, Macquart, Lynch-Arribalzaga puis Williston apportent leur remaniement à la classification de ce qui deviendra la famille des Culicidae, créant les genres Megharinus (actuel Toxorhynchites), Psorophora, Sabethes, Ochlerotatus, Taeniorhynchus (actuel Mansonia), Ianthinosoma, Heteronycha, Uranotaenia et Hodgesia.
À la toute fin du XIXe siècle, le monde scientifique découvrit soudainement que les moustiques transmettaient de graves maladies telles que les filarioses (1878), le paludisme (1880) et la fièvre jaune (1900). Cette découverte provoqua la prospection intense de moustiques dans le monde entier, enrichissant les musées et permettant une étude plus poussée de la taxonomie de ce groupe. Travaillant au British Museum de Londres, Frederick Vincent Theobald, dans son ouvrage en six volumes, A Monograph of the Culicidae of the World, paru de 1901 à 1910, créa de nombreux genres pour déboucher sur une classification de la famille comprenant six sous-familles. Frederick Wallace Edwards, en 1932, inclut au rang de sous-famille les dixines et chaoborines dans la famille des Culicidae, les moustiques formant la sous-famille des Culicinae divisée en 3 tribus : Anophelini, Toxorhynchitini et Culicini, ces derniers divisés en 5 groupes : Sabethes, Uranotaenia, Theobaldia (actuel Culiseta), Aedes et Culex.
Stone, en 1957, supprima les Dixinae et Chaoborinae des Culicidae et en 1959, Knight, Stone et Starke, dans leur ouvrage A synoptic Catalog of the Mosquitoes of the World (Diptera, Culicidae) reconnaissent 3 sous-familles : Anophelinae, Toxorhynchitinae et Culicinae, ces derniers divisés en 2 tribus : les Culicini et les Sabethini. Belkin en 1962 réintègre Chaoborinae et Dixinae mais subdivise les Culicinae en 10 tribus. Knight et Stone, pour la réédition de leur catalogue en 1977, adoptent dans son ensemble la classification de Belkin en excluant toutefois Chaoboridae et Dixidae.
Durant ces dernières décennies, le nombre d’espèces et de sous-genres a considérablement augmenté, avec des remaniements taxonomiques à divers niveaux. Ainsi, Harbach & Kitching (1998), inclurent la sous famille des Toxorhynchitinae dans la sous famille des Culicinae, la ramenant au rang de tribu (Toxorhynchitinii). Reinert et al, (2000) divisèrent, sur la base des génitalia mâles et femelles, le prolifique genre Aedes en deux genres : Aedes, conservant 23 sous-genres et le genre Ochlerotatus (anciennement sous-genre du genre Aedes) captant 21 sous-genres. Dernièrement, Reinert et al (2004, 2009) proposèrent de diviser la tribu des Aedini en 63 genres au lieu de 12 mais ils furent peu suivis.
En 1959, 2 462 espèces de moustiques étaient décrites et validées de par le monde, 3 209 espèces en 1992 pour un total actuel atteignant 3 523 espèces réparties en 44 genres et 145 sous-genres. La classification phylogénétique n'est toujours pas totalement définie. Si certaines tribus sont monophylétiques (Aedini, Culicini et Sabethini), la phylogénie de la plupart des tribus reste incertaine (Harbach & Kitching,1998 ; Harbach, 2007). Toutefois, l'apport, cette dernière décennie, de nouvelles techniques d'analyse génétique, couplée aux techniques d'analyse morphotaxonomique classiques, permettent de progresser rapidement dans ce domaine.
À ce jour (Harbach, 2010), 3 523 espèces de moustiques sont décrites au niveau mondial, réparties (Harbach & Kitching, 1998) en deux sous-familles : Anophelinae (478 espèces), Culicinae (3046 espèces) et 44 genres. Pour être complet, il faut rajouter à cette liste 156 sous espèces.
Liste des sous-familles, tribus, genres et sous-genres
D'après Harbach, 2010
- sous-famille Anophelinae
- genre Anopheles Meigen, 1818 (7 sous-genres, 464 espèces : régions néotropicale, afrotropicale, asiatique)
- sous-genre Anopheles Meigen,1818 (188 espèces : région afrotropicale)
- sous-genre Cellia Theobald, 1902 (217 espèces : Ancien Monde)
- sous-genre Kerteszia Theobald, 1905 (12 espèces : région néotropicale)
- sous-genre Lophodomyia Antunes, 1937 (6 espèces : région néotropicale)
- sous-genre Nyssorhynchus Blanchard, 1902 (28 espèces : région néotropicale)
- sous-genre Stethomyia Theobald, 1902 (région néotropicale)
- genre Bironella Theobald, 1905 (3 sous-genres, 8 espèces : région australasienne)
- sous-genre Bironella Theobald, 1905 (2 espèces)
- sous-genre Brugella Edwards, 1930 (3 espèces)
- sous-genre Neobironella Tenorio, 1977(3 espèces)
- genre Chagasia Cruz, 1906 (4 espèces : région néotropicale)
- genre Anopheles Meigen, 1818 (7 sous-genres, 464 espèces : régions néotropicale, afrotropicale, asiatique)
- sous-famille Culicinae Meigen, 1818 (44 genres)
Du fait de leur abondance, les sous-genres ne sont pas cités pour cette sous-famille. Se reporter pour cela à la page de chaque genre.
- Tribu Toxorhynchitini
- genre Toxorhynchites Theobald, 1901 (4 sous-genres, 91 espèces)
- sous-genre Toxorhynchites Theobald, 1901(56 espèces et sous espèces: présent sur l'Ancien Monde)
- sous-genre Afrorhynchus Ribeiro, 1992 (20 espèces : uniquement présent en région afrotropicale)
- sous-genre Ankylorhynchus Lutz, 1904 (4 espèces : Nouveau Monde)
- sous-genre Lynchiella Lahille, 1904 (16 espèces : Nouveau Monde)
- genre Toxorhynchites Theobald, 1901 (4 sous-genres, 91 espèces)
- Tribu Aedeomyiini
- Aedeomyia Theobald, 1901 (2 sous-genres, 6 espèces : régions afrotropicale, néotropicale, orientale et australasienne)
- Tribu Aedini Neveu-Lemaire, 1902
- Aedes Meigen, 1818 (257 espèces, 22 sous-genres : cosmopolite)
- Armigeres Theobald, 1901 (2 sous-genres, 58 espèces : région orientale, australasienne)
- Ayurakitia Thurman, 1954 (2 espèces : région asiatique (Thaïlande))
- Borichinda Harbach & Rattanarithikul, 2007 (1 espèce : région orientale)
- Bothaella Reinert, 1973 (6 espèces : région asiatique)
- Coetzeemyia Huang et al, 2010 (1 espèce : région ouest de l'Océan Indien))
- Eretmapodites Theobald, 1901 (48 espèces : région afrotropicale exclusivement)
- Haemagogus Williston, 1896 (2 sous-genres, 28 espèces : région néotropicale principalement)
- Heizmannia Ludlow 1905 (2 sous-genres, 39 espèces : région orientale)
- Levua Stone et Bohart, 1944 (1 espèce : région ouest de l'Océan Indien))
- Ochlerotatus Lynch Arribalzaga, 1891 (22 sous-genres, 550 espèces : cosmopolite)
- Opifex Hutton, 1902 (2 espèces : Nouvelle-Zélande)
- Psorophora Robineau-Desvoidy, 1827 (3 sous-genres, 48 espèces : Nouveau Monde)
- Udaya Thurman, 1954 (3 espèces : région orientale)
- Verrallina Theobald, 1903 (3 sous-genres, 95 espèces : région australasienne, orientale essentiellement)
- Zeugnomyia Leicester, 1908 (4 espèces : région orientale)
- Tribu Culicini Meigen, 1818
- Culex Linnaeus, 1758 (23 sous-genres, 763 espèces : cosmopolite)
- Deinocerites Theobald, 1901 (18 espèces : Nouveau Monde)
- Galindomyia Stone & Barreto, 1969 (1 espèce : région néotropicale (Colombie))
- Lutzia Theobald, 1903 (3 sous-genres, 7 espèces : cosmopolite, initialement sous-genre du genre Culex, ressuscité par Tanaka (2003) au rang de genre)
- Tribu Culisetini
- Culiseta Felt, 1904 (37 espèces : région néarctique, ancien monde)
- Tribu Ficalbiini
- Ficalbia Theobald, 1903 (8 espèces : régions afrotropicale (4 spp.), orientale (3spp.), australasienne)
- Mimomyia Theobald, 1903 Theobald (3 sous-genres, 42 espèces : régions afrotropicale, orientale, australasienne)
- Tribu Hodgesiini
- Hodgesia Theobald, 1904 (11 espèces : régions afrotropicale, orientale, australasienne)
- Tribu Mansoniini
- Coquillettidia Dyar, 1905 (66 espèces : région afrotropicale, néotropicale, australasienne)
- Mansonia Blanchard, 1901 (24 espèces : région afrotropicale, Ancien Monde)
- Tribu Orthopodomyiini
- Orthopodomyia Theobald, 1904 (38 espèces : cosmopolite, pas d'importance médicale - ne piquent pas l'homme-)
- Tribu Uranotaeniini
- Uranotaenia Lynch Arribalzaga, 1891 (2 sous-genres, 274 espèces : région afrotropicale, orientale, asiatique)
- Tribu Sabethini
- Isostomyia Coquillett, 1906 (4 espèces : région néotropicale)
- Johnbelkinia Zavortink, 1979 (3 espèces : région néotropicale)
- Limatus Theobald, 1901 (8 espèces : région néotropicale)
- Malaya Leicester, 1908 (12 espèces : régions afrotropicale, orientale, australasienne, ex genre « Harpagomyia »)
- Maorigoeldia Edwards (une espèce : Nouvelle-Zélande)
- Onirion Harbach & Peyton, 2000 (7 espèces : région néotropicale, issu du genre Wyeomyia Theobald)
- Runchomyia Theobald (7 espèces : région néotropicale)
- Sabethes Robineau-Desvoidy, 1827(5 sous-genres, 38 espèces : région néotropicale)
- Shannoniana Lane & Cerqueira (3 espèces : région néotropicale)
- Topomyia Leicester, 1908 (2 sous-genres, 58 espèces : région orientale, australasienne)
- Trichoprosopon Theobald, 1901 (13 espèces : région néotropicale)
- Tripteroides Giles, 1904 (5 sous-genres, 122 espèces : régions orientale, australasienne)
- Wyeomyia Theobald (15 sous-genres, 140 espèces : région néotropicale principalement, Nouveau Monde)
Bio-indicateur
Une distinction essentielle concerne la manière dont pondent les différentes espèces. Certaines (genre Aedes) pondent leurs œufs sur des zones humides temporaires, donc dans des secteurs susceptibles de se mettre en eau et de s'assécher au gré des conditions climatiques. Leurs œufs peuvent survivre à la dessiccation. D'autres espèces (genres Culex, une partie des Anopheles) pondent leurs œufs à la surface des eaux stagnantes.
Pour les Aedes, la prolifération en très grand nombre est due à des événements climatiques importants (fortes précipitations après une longue période de sécheresse). Il y a alors apparition concomitante d'une très grande quantité de larves aquatiques, due à la submersion d'une grande quantité d'œufs. Quelques jours plus tard, les adultes (imago) vont apparaître.
Ceci est un phénomène naturel qui n'a rien à voir avec une action anthropique. Dans ce cas, le moustique ne peut être considéré que comme un bio-indicateur. De même, pour les autres espèces appartenant aux genres précités, même si parfois leur nombre augmente avec la teneur en matière organique, il est toujours délicat de les utiliser comme bio-indicateurs. C'est pour cela qu'ils ne figurent jamais dans les différents indices biotiques existants (IBGN par exemple) établis pour les rivières, peu colonisées par les moustiques.
Évolution
Les moustiques sont apparus probablement au Jurassique, il y a environ 170 millions d'années. Le fossile le plus ancien date du Crétacé. Les moustiques étaient alors environ trois fois plus gros que les espèces actuelles et étaient un groupe voisin des Chaoboridae (moucherons piquants).
Moustiques et aquariophilie
Les larves de moustique sont utilisées comme nourriture en aquariophilie, et sont commercialisées sous trois formes : lyophilisées, congelées ou vivantes.
Vivantes, elles sont appréciées par les poissons prédateurs : cichlidés, combattants, gouramis…
Il est facile de se procurer des larves de moustique en laissant croupir de l'eau dans un récipient (l'ajout d'herbe coupée ou d'une branche peut accélérer le processus). Après quelques semaines, vous pourrez récolter avec une épuisette pour aquarium une multitude de larves.
Nomenclature et étymologie
Les moustiques sont dénommés maringouins au Canada[57], aux Antilles françaises et en Louisiane[58], mais ce terme peut également désigner d'autres insectes apparentés.
Étymologie
Culicidae vient du celte kuli signifiant moucheron.
Moustique est attesté en français à partir de 1654. Il est issu du latin musca, la mouche qui, en espagnol, a donné mosca et mosquito, lui-même devenu « mousquitte » en français à partir de 1601-03 et enfin moustique, probablement en référence à la tique (mouche-tique), ce qui explique que le mot n'a pas encore de genre grammatical bien défini au XVIIe siècle[59].
Maringouin a pour origine un mot indigène provenant de marui, maruim ou mbarigui en langage tupi et guarani. En 1566, ce mot indigène est devenu maringon, puis marigoin en 1609 et enfin maringouin en 1614, dans les livres d'histoire locale. Il est adopté comme mot francophone depuis 1718[60].
Histoire
Moustique : Dans le Dictionnaire de l'Académie française, le moustique est d'abord défini, dans la 4e édition de 1762, comme un insecte caractérisé par sa petite taille et sa piqûre douloureuse qui « laisse sur la peau une tache semblable à celles du pourpre ». Il est alors localisé seulement en Afrique et en Amérique. Cette définition persiste dans les éditions suivantes bien que le genre change de féminin (édition de 1762) à masculin (édition de 1832). Il faut attendre la 8e édition (1932-5) pour que le moustique soit défini plus précisément comme un diptère mais sans plus de localisation géographique. Sa piqûre n'est plus seulement douloureuse mais également dangereuse et « peut véhiculer les germes de certaines maladies[61] ».
Plus récemment, le Trésor de la Langue Française (1971-1994) précise encore qu'il s'agit d'un diptère nématocère, que seule la femelle pique et qu'elle pique l'homme et les animaux « pour se nourrir de leur sang[62] ». Par analogie on qualifie de « moustique » un individu de petite taille et toujours en mouvement, généralement un enfant[62].Cousin : Le Dictionaire critique de la langue française (1787-1788) de Jean-François Féraud, précise qu'en France on nomme le moustique « cousin[61] », mot qui, d'après le Trésor de la Langue Française (1971-1994), tend à ne désigner à présent que les moustiques non dangereux et surtout les espèces françaises de très grande taille (Tipula spp., qui relèvent en fait non pas de la famille des Culicidae mais de celle des Tipulidae)[62].
Maringouin : Dans le Dictionnaire de l'Académie française, le maringouin est d'abord défini, dans la 4e édition de 1762, comme un moucheron d'Amérique « qui ressemble au cousin », nom donné couramment en France à cette époque au moustique. Ce n'est que dans la 6e édition (1832-5) qu'apparait l'idée d'un éventuel lien plus précis entre le maringouin des « voyageurs » avec le « genre des cousins ». Ce lien est avéré dans la 8e édition (1932-5) puisqu'il y est indiqué qu'il ne s'agit en fait que d'un « nom vulgaire » donné à certaines espèces de cousins aux Antilles et « autres pays chauds[63] ».
Noms français et noms scientifiques correspondants
Note : certaines espèces ont plusieurs noms.
- Anophèle - Anopheles sp.
- Cousin commun - voir Moustique commun[64]
- Maringouin - Culicidae sp.[65],[64]
- Maringouin commun - voir Moustique commun
- Maringouin domestique - voir Moustique commun[65]
- Moustique commun - Culex pipiens[64]
- Moustique domestique - voir Moustique commun[64]
- Moustique de la Sarracénie - Wyeomyia smithii[65]
- Moustique tigre ou Moustique tigre d'Asie - Aedes albopictus[64]
- etc.
Notes et références
- Les moustiques émission La Tête au carré du 9 septembre 2010.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 25.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 24.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 22.
- L'endophilie et l'exophilie désignent respectivement les moustiques adultes qui passent l'essentiel de leurs journées à l'intérieur et à l'extérieur des maisons ; l'endophagie n'implique pas l'endophilie et vice-versa.
- (en)PETERSON, E. L., 1980 A limit cycle interpretation of a mosquito circadian oscillator, J. Theor. Biol. 84 : 281–310. Medline.
- http://www.eid-med.org/fr/Moustique/moustiqBiologieCentre.htm#Dur%C3%A9e%20de%20vie%20des%20adultes%C2%A0.
- Pourquoi ce ne sont que les moustiques femelles qui piquent et que mangent les mâles ? émission Les P'tits Bateaux de France Inter, 26 septembre 2010.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010.
- Les moustiques ont deux odorats !, sur le site de Futura-sciences.
- (fr)Ces petites bêtes qui nous embêtent. sur www.tv5.org. Consulté le 9 mai 2010.
- (fr)Les moustiques du palu aiment la bière. sur effetsdeterre.fr.
- (fr)Pourquoi les moustiques sont plus attirés par certaines peaux. sur www.pourquois.com.
- (fr)L’anophèle piégé par une chaussette sale sur mondedurable.science-et-vie.com -consulté le=9 mai 2010.
- (fr)[PDF] Réactions allergiques aux piqûres de moustiques, quelle prévention ? sur www.allergienet.com.
- Roland Garrigue, François Lasserre, Toutes les bêtises sur la nature que les grands racontent aux enfants, Delachaux et Niestlé, 2010, 128 p.
- (fr)Progrès en dermato-allergologie, Lille 2004, Paul Frimat, Marie-Bernadette Cleenewerck, Collectif. sur Book.google. Consulté le 9 mai 2010.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 27.
- (fr)Les moustiques. sur www.chambon. Consulté le 9 mai 2010.
- (fr)Semaine sans pesticides : 5 conseils pour jardiner bio. sur Futura-Maison. Consulté le 9 mai 2010.
- (fr)Faune et flore du Canada - Moustique sur Faune et flore du pays. Consulté le 9 mai 2010.
- http://www.operation-moustique.eu/fiches/fiche07.pdf.
- Imaginez un monde sans moustiques, Courrier International, numéro 1049, article traduit en français depuis un article publié en anglais dans la revue Nature, 466, 432-434 (2010) : (en) Ecology: A world without mosquitoes, Janet Fang.
- (fr)La Dengue en quelques mots sur Scienc'@ction. Consulté le 9 mai 2010.
- (Clements, 2000).
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 43.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 21.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 33.
- http://www.futura-sciences.com/fr/news/t/recherche/d/des-arbres-contre-le-paludisme_8363/.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 37.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 36.
- G.Sinègre, J.-L. Julien et B. Gaven, Évaluation préliminaire des potentialités de la perméthrine dans la lutte antilarvaire contre les moustiques dans le sud de la France. Cah. O.R.S.T.O.M., sdv. Ewt. méd. et Parasitol., vol. XVIII, no 3, 1980 : 195-199.
- Pesticides et Biopesticides sur le site de l'UERBV Unité d’Entomologie, de Rickettsiologie, de Bactériologie et de Virologie à l'université de Dakar.
- R. Romi, G. Sabatinelli, G. Pontuale, 1997. Aedes atropalpus, un nouveau moustique importé en Italie lors de transports de pneus usagés. Editions Princeps, Paris, France. Parasite 1997, vol. 4, n°4, pp. 343-349 (24 ref.)- ISSN 1252-607X.
- Bonnet, D.D. & Hu, S.M.K. (1951). The introduction of Toxorhynchites brevipalpis into the Territory of Hawaii. Proceedings of the Hawaiian Entomological Society 14 : 237-242.
- Miyagi I., Tomai T., Mogis M. (1992). Biological control of container-breeding mosquitoes, Aedes albopictus and Culex quinquefasciatus, in a Japanese island by release of Toxorhynchites splendens adults. Medical and Veterinary Entomology 6, 290-300.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 40.
- (fr)Dr Tennstedt, « Peaux et moustiques ». Dans Progrès en dermato-allergologie - Lille 2004. Groupe d'études et de recherches en dermato-allergologie (Lire en ligne page pp 91-104 sur Book-Google.
- J. M. Hougard, « Les moustiquaires imprégnés », Pour la Science, avril 2008, p. 48-52.
- Moustique, ennemi public, revue La Salamandre, n°199, août 2010, p. 41.
- http://www.futura-sciences.com/fr/question-reponse/t/ete-1/d/comment-se-proteger-des-moustiques_394/.
- Un répulsif anti-moustiques, très utilisé, serait peut-être toxique.
- Mark S. Fradin, M.D. et John F. Day, « Comparative Efficacy of Insect Repellents against Mosquito Bites », New England Journal of Medicine, volume 347 : 13-18 July 4, 2002, n° 1.
- « Mais les produits mis au point jusqu'à présent ne semblent pas fonctionner, comme le montre une compilation [de dix] études menées aux États-Unis en 2009 », 60 millions de consommateurs, juillet-août 2010, no 45, p. 69.
- (en)Enayati AA, Hemingway J, Garner P., « Electronic mosquito repellents for preventing mosquito bites and malaria infection », Cochrane Database Syst Rev., 2007 18 ; CD005434.
- http://www.futura-sciences.com/fr/news/t/high-tech-4/d/une-sonnerie-de-portable-qui-eloigne-les-moustiques_4190/.
- (fr)[PDF]Réactions allergiques aux piqûres de moustiques, quelle prévention ?, C. Feuillet-Dassonval, F. Lavaud, H. Viniaker, E. Bidat sur www.allergienet.com. Consulté le 9 mai 2010.
- Rodolphe Poupardin (Thèse en ligne), Interactions gènes-environnement chez les moustiques et leur impact sur la résistance aux insecticides, PDF, Université de Grenoble, mars 2011 (Voir notamment le chapitre « La résistance aux pesticides, un modèle d'adaptation rapide »)
- Hemingway, J., Field, L., Vontas, J., 2002. An overview of insecticide resistance. Science 298, 96–97.
- Hemingway, J., Hawkes, N.J., McCarroll, L., Ranson, H., 2004. The molecular basis of insecticide resistance in mosquitoes. Insect Biochem. Mol. Biol. 34, 653–665.
- Hemingway, J. and H. Ranson. 2000. Insecticide resistance in insect vectors of human disease. Annual Review of Entomology 45:371-391.
- Akogbeto, M. C., R. F. Djouaka, and D. A. Kinde-Gazard. 2006. Screening of pesticide residues in soil and water samples from agricultural settings. Malaria Journal
- Djouaka, R. F., A. A. Bakare, H. S. Bankole, J. M. C. Doannio, O. N. Coulibaly, H. Kossou, M. Tamo, H. I. Basene, O. K. Popoola, and M. C. Akogbeto. 2007. Does the spillage tel-00583441, version 1 - 5 Apr 2011 257 of petroleum products in Anopheles breeding sites have an impact on the pyrethroid resistance? Malaria Journal
- Ranson, H., H. Abdallah, A. Badolo, W. M. Guelbeogo, C. Kerah-Hinzoumbe, E. Yangalbe- Kalnone, N. Sagnon, F. Simard, and M. Coetzee. 2009. Insecticide resistance in Anopheles gambiae: data from the first year of a multi-country study highlight the extent of the problem. Malaria Journal
- Yadouleton, A. W. M., A. Asidi, R. F. Djouaka, J. Braima, C. D. Agossou, and M. C. Akogbeto. 2009. Development of vegetable farming: a cause of the emergence of insecticide resistance in populations of Anopheles gambiae in urban areas of Benin. Malaria Journal
- Selon Dr. Francis Schaffner, chercheur en entomologie médicale et vétérinaire à l'Université de Zürich, « La lumière n’est pas du tout attractive pour les moustiques, elle attire tout un tas d’insectes, mais pas les moustiques. En fait ce qui les attire, quand on a la fenêtre ouverte, d’ailleurs vous pouvez en faire l’expérience, vous ouvrez la fenêtre, éteignez la lumière et vous serez quand même piqué. En fait, ce qui l’attire, c’est le CO2 qui sort par la fenêtre. »
- Terme emprunté au tupi-guarani. Entrée « Maringouin » sur Grand dictionnaire terminologique, OQLF.
- Centre National de Ressources textuelles et Lexicales : maringouin.
- Centre National de Ressources textuelles et Lexicales : moustique.
- Centre National de Ressources textuelles et Lexicales : maringouin.
- Moustique dans les Dictionnaires d'autrefois, des 17ème, 18ème, 19ème et 20ème siècles, sur Atilf.
- moustique dans le TLFi, issu du Trésor de la Langue Française (1971-1994). Sur le portail cnrtl.
- Maringouin dans les Dictionnaires d'autrefois, des 17ème, 18ème, 19ème et 20ème siècles, sur Atilf.
- Meyer C., ed. sc., 2009, Dictionnaire des Sciences Animales. consulter en ligne. Montpellier, France, Cirad.
- Nom vernaculaire français d'après Dictionary of Common (Vernacular) Names sur Nomen.at.
Voir aussi
Bibliographie
- Systématique :
- Neveu-Lemaire M. (1923). L’évolution de la classification des Culicidae. Annales de Parasitologie. T. 1 (1). 18 p.
- Harbach R. E. & Peyton E. L. (2000). Systematics of Onirion, a new. genus of Sabethini (Diptera : Culicidae) from the Neotropical region. Bull. nut. Hist. MUS. Lond. (Ent.) 69(2): 115-169. http://www.mosquitocatalog.org/pdfs/wr363.pdf.
- Harbach R. E. (2007) The Culicidae (Diptera): a review of taxonomy, classification and phylogeny. Zootaxa 1668:591–638.
- Reinert, J.F. (2000). New classification for the composite genus Aedes (Diptera: Culicidae: Aedini), elevation of subgenus Ochlerotatus to generic rank, reclassification of the other subgenera, and notes on certain subgenera and species. Journal of the American Mosquito Control Association, 16, 175–188.
- Systématique et biologie :
- Lane R. & Crosskey. (1993). Medical insects and arachnids. The natural History Museum. London. 723 p. (ISBN 0-412-40000-6).
- Rôle vecteur :
- Takashima I. & Rosen L. (1989), « Horizontal and vertical transmission of Japanese encephalitis virus by Aedes japonicus (Diptera: Culicidae) », dans Journal of medical entomology, Vol. 26 (5), p. 454-458. (ISSN 0022-2585).
- Rosen L. (1988), « Further observations on the mechanism of vertical transmission of flaviviruses by Aedes mosquitoes », The American journal of tropical medicine and hygiene, Vol. 39, no1, p. 123-126. (ISSN 0002-9637).
- Contre les piqûres de moustique :
- Mark S. Fradin, M.D. et John F. Day, « Comparative Efficacy of Insect Repellents against Mosquito Bites », New England Journal of Medicine, volume 347 : 13-18, 4 juillet 2002, no 1.
- Yves Sciama, « Moustiques, la grande menace », in Sciences et Vie, juin 2006.
- « Moustique, ennemi public », revue La Salamandre, no 199, août 2010.
Articles connexes
- Chironome et Tipule, deux types d'insectes Diptères pouvant être confondus avec les Culicidae.
- Glossaire des insectes
Références taxonomiques
- Référence Fauna Europaea : Culicidae (en)
- Référence ITIS : Culicidae (fr) ( (en))
- Référence Animal Diversity Web : Culicidae (en)
Liens externes
- Critères de détermination de Culicidae au stade larvaire et imaginal (pdf)
- Article sur les larves de moustique en aquariophilie (www.aquabase.org)
- Moustique, Faune et flore du Canada
- (en) European Mosquito Bulletin
Catégories :- Culicidé
- Nourriture en aquariophilie
- Insecte vecteur
Wikimedia Foundation. 2010.