- Diagramme de Klechkowski
-
Règle de Klechkowski
La règle de Klechkowski (aussi appelée règle de Madelung) est une méthode empirique qui décrit l'ordre de remplissage des électrons dans les orbitales d'un atome. Avec la règle de Hund et le principe d'exclusion de Pauli, elle constitue l'un des outils de bases permettant l'étude des orbitales atomiques dans le modèle de Bohr.
Sommaire
Règle de Klechkowski
Énoncé
La règle de Klechkowski énonce que :
- « Les orbitales sont remplies de sorte que n + l soit croissant ; »
où n est le nombre quantique principal et l le nombre quantique secondaire. De plus,
- « En cas d'égalité, la sous-couche ayant le plus petit n est remplie en premier. »
Il existe cependant de nombreuses exceptions, liées aux stabilités particulières des orbitales saturées, qui préfèreront ainsi se compléter, au détriment éventuel d'autres couches déjà remplies. Les exceptions principales sont :
Pour ces atomes, et souvent pour des atomes proches susceptibles de former des ions isoélectroniques de ces atomes, on préfère écrire les configurations électroniques dans l'ordre réel des niveaux d'énergie, ce qui revient souvent à inverser les orbitales s et p de valence.
Représentation de la configuration électronique
Les orbitales sont représentées par leur nombre principal, n, et par une lettre représentant leur nombre secondaire l. Éventuellement, on note les orbitales dégénérées en indice. Enfin, le nombre d'électrons sur l'orbitale est noté en exposant. On utilise :
- « s » pour l = 0 (de l'anglais : sharp) ;
- « p » pour l = 1 (principal) ;
- « d » pour l = 2 (diffuse) ;
- « f » pour l = 3 (fondamental) ;
- « g », « h »… (continuation de l'alphabet)
Par exemple, l'orbitale n = 5, l = 3 contenant 14 électrons est notée : 5f14. On peut écrire successivement toutes les orbitales d'un atome en partant de la première 1s¹, mais on préfère généralement partir d'un gaz rare. Pour le fer, on écrira indifféremment l'une des trois formules suivantes :
![\left[\mathrm{Fe} \right] = 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6](/pictures/frwiki/50/2e46a7cde46fa2cb94661dfa2590cada.png) ; (forme complète)
; (forme complète)![\left[\mathrm{Fe} \right] = \left[\mathrm{Ar} \right] 4s^2 3d^6](/pictures/frwiki/50/223f2100c4068192871079ae0557f963.png) ; (forme abrégée rapportée à l'Argon)
; (forme abrégée rapportée à l'Argon)![\left[\mathrm{Fe} \right] = \left[\mathrm{Ar} \right] 3d^6 4s^2](/pictures/frwiki/55/7985091d9def232be08b32695a8067ab.png) . (forme abrégée classée par énergie)
. (forme abrégée classée par énergie)
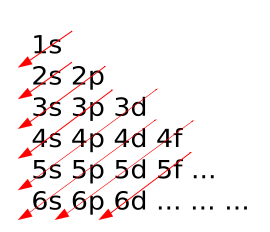
Diagramme de Klechkowski
Le diagramme de Klechkowski est un moyen mnémotechnique, permettant de retrouver cette règle. On accède ainsi à l'ordre de remplissage des couches électroniques d'un élément chimique.
Sa construction est relativement simple :
- Toutes les couches s sont mises en diagonale ;
- Puis on rajoute les couches suivantes (p, d, f, etc.) sur la ligne.
La lecture se fait ensuite le long des colonnes. On trouve donc l'ordre de remplissage suivant :
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s…
Quelques exemples :
- Pour l'atome d'oxygène (Z = 8, soit 8 électrons à placer) : 1s2 2s2 2p4 ;
- Pour l'atome de cobalt (Z = 27, soit 27 électrons à placer) : 1s2 2s2 2p6 3s2 3p6 4s2 3d7.
Pour certains atomes, on préfère réarranger l'ordre des orbitales de sorte à ce qu'elles correspondent aux niveaux d'énergie croissant. Ainsi, la configuration du cobalt pourra aussi être décrite sous la forme :
- 1s2 2s2 2p6 3s2 3p6 3d7 4s2
Exceptions
Certains atomes ne respectent pas le principe de Klechkowski, notamment le cuivre, l'argent, l'or, le chrome, le molybdène ou encore le palladium. En effet, dans ces atomes, on observe une couche d demi ou remplie, et une couche s dégarnie, alors qu'elle devrait être complètement remplie. Un gain de stabilité des couches remplies et semi-remplie en est la cause.
Voir aussi
- Portail de la physique
- Portail de la chimie
Catégories : Chimie quantique | Physique atomique
Wikimedia Foundation. 2010.