- Acétate de sodium
-
Acétate de sodium 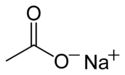
Général Nom IUPAC Éthanoate de sodium Synonymes Acétate de soude
Sel sodique de l'acide acétiqueNo CAS (anhydre)
(trihydrate)No EINECS No E E262(i) FEMA SMILES InChI Apparence poudre cristalline blanche, hygroscopique[1]. Propriétés chimiques Formule brute C2H3NaO2 [Isomères] Masse molaire[2] 82,0338 ± 0,0024 g·mol-1
C 29,28 %, H 3,69 %, Na 28,02 %, O 39,01 %,
136,08 g/mol (trihydrate)pKa 4,75 (pKb = 9.25) Propriétés physiques T° fusion 324 °C [3] Solubilité 365 g·l-1 (eau, 20 °C))[4] Masse volumique 1,52 g·cm-3 (anhydre, 20 °C)[4],
1,42 g·cm-3 (trihydrate, 20 °C)[4]T° d'auto-inflammation 607 °C[4] Point d’éclair > 250 °C (anhydre, coupelle fermée)[4] Précautions Directive 67/548/EEC 
XiPhrases S : 24/25, SIMDUT[5],[6] Acétate de sodium :
Produit non contrôlé
Acétate de sodium trihydraté :
Produit non contrôléUnités du SI & CNTP, sauf indication contraire. L'acétate de sodium est un composé de formule CH3COONa. Il est soluble dans l'eau et constitue une bonne source d'ions acétate. Sa solution aqueuse est basique en raison de la réaction :
- CH3COO- Na+ + H2O
 CH3COOH + HO- Na+.
CH3COOH + HO- Na+.
Ce composé est utilisé pour faire des expériences simples de solutions aqueuses sursaturées.
Sommaire
Synthèse
L'acétate de sodium apparaît comme sous-produit de la saponification des acétates d'alkyle par la soude. Il peut également être extrait en distillant le produit de réaction d'une solution d'acide acétique (ou éthanoïque) de formule CH3-COOH et de soude NaOH.
Réactions
L'acétate de sodium peut être utilisé pour synthétiser des esters suivant la réaction :
CH3COONa + RBr → CH3COOR + NaBr
Utilisations
On retrouve dans le commerce des pochettes vendues comme sources de chaleur portatives (chaufferettes). Ces pochettes contiennent une solution aqueuse saturée en acétate de sodium en sursaturation, la température de dissolution étant à 54 °C pour une solution à 20%, ce qui est bien au-dessus de la température ambiante. Une variation de pression (par trituration) ne suffit pas, en règle générale, à provoquer la précipitation. En tordant une plaquette métallique à l'intérieur du liquide, on libère des germes d'acétate solidifié qui déclenchent la cristallisation et la solution devient solide[7]. Cette transformation est exothermique, ce qui signifie qu'elle s'accompagne d'un dégagement de chaleur, suffisant pour procurer un réconfort à l'utilisateur. On dissout à nouveau le sel en plaçant la pochette dans de l'eau très chaude ; même en refroidissant, l'acétate de sodium demeure en solution.
L'acide acétique est un acide naturel dont le sel est un agent conservateur (numéro E262) présent dans les fruits et les produits fermentés[8].
Notes et références
- ACETATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- PhysProp Database. Consulté le 19 Novembre 2011
- Entrée de « Sodium acetate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 avril 2009 (JavaScript nécessaire)
- « Acétate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acétate de sodium trihydraté » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Courty JM, Kierlik E, Les chaufferettes chimiques, Pour la Science, décembre 2008, p 108-110
- Food-Info.net > E262 : Acétate de sodium
Voir aussi
Articles connexes
- Portail de la chimie
- Portail des odeurs, des senteurs et du parfum
Catégories :- Composé du sodium
- Produit chimique irritant
- Acétate
- Agent conservateur
- Régulateur alimentaire de pH
- Séquestrant
- Arôme
- CH3COO- Na+ + H2O
Wikimedia Foundation. 2010.

