- Disulfure de carbone
-
Sulfure de carbone
 Pour les articles homonymes, voir CS2.
Pour les articles homonymes, voir CS2.Sulfure de carbone 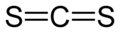

Général Nom IUPAC Disulfure de carbone Synonymes Anhydride sulfocarbonique
Bisulfure de carboneNo CAS No EINECS Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute CS2 [Isomères] Masse molaire 76,141 g∙mol-1
C 15,77 %, S 84,23 %,Propriétés physiques T° fusion -111 °C[1] T° ébullition 46 °C[1] Solubilité dans l'eau à 20 °C : 0.2 g/100 ml[1] Masse volumique (eau = 1) : 1.26[1] T° d’auto-inflammation 90 °C[1] Point d’éclair -30 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 1-50[1] Pression de vapeur saturante à 25 °C : 48 kPa[1] Viscosité dynamique 0,36 mPa.s à 25 °C Conductivité thermique 0,162 W⋅m-1⋅K-1 à 20 °C Conductivité électrique 78×10-19 Ω-1⋅cm-1 à 18 °C Thermochimie S0gaz, 1 bar 237,83 J⋅mol-1⋅K-1 Cp 76,45 J⋅mol-1⋅K-1
à 25 °C (liquide)Précautions Directive 67/548/EEC[2] 
T
FPhrases R : 11, 36/38, 48/23, 62, 63, Phrases S : 1/2, 16, 33, 36/37, 45, Transport 336 1131 NFPA 704 SIMDUT[3] 

SGH[4] 

DangerÉcotoxicologie LogP 1.84[1] Unités du SI & CNTP, sauf indication contraire. Le sulfure de carbone, de formule chimique CS2, est un solvant très toxique, utilisé en chimie pour dissoudre de nombreux composants organiques, ainsi que le soufre, le phosphore blanc, le sélénium, le diiode, le caoutchouc ou les résines et les cires. Il est aussi utilisé comme intermédiaire de synthèse dans la fabrication de nombreux composés organiques soufrés : agents de vulcanisation du caoutchouc, produits pharmaceutiques, produits phytosanitaires (fongicides, insecticides). Au XIXe siècle, il fut utilisé pour lutter contre le phylloxéra de la vigne.
Sommaire
Propriétés physiques
Le sulfure de carbone est un liquide dense et volatil, avec un haut degré d'inflammabilité dans l'air, une température d'auto-inflammation remarquablement basse ainsi qu'une sensibilité exacerbée à l'électricité statique.
Occurrence et synthèse
De petites quantités de disulfure de carbone sont synthétisées lors des éruptions volcaniques et dans les marais. Dans l'industrie CS2 était produit à partir de charbon (ou de coke) et de soufre à haute température. La filière gaz naturel utilise une température de réaction plus basse de l'ordre de 600 °C, réaction catalysée par du gel de silice ou de l'alumine [5]
- CH4 + 1/2 S8 -> CS2 + 2 H2S
Cette réaction est analogue à la combustion du méthane. Bien que structurellement similaire au dioxyde de carbone , CS2 est extrêmement inflammable :
- CS2 + 3 O2 -> CO2 + 2 SO2
Réactions
Comparé au dioxyde de carbone, CS2 est plus réactif vis à vis des nucléophiles et est plus facile à réduire. Cette différence de réactivité s'explique par le caractère p-donneur faible du soufre qui rend le carbone plus électrophile. Cette réactivité est très utilisée pour la synthèse de composés organosulfurés.
Additions nucléophiles
Les nucléophiles comme les amines réagissent pour donner des dithiocarbamates:
- 2R2NH + CS2 -> [R2NH2+][R2NCS2-]
Les xanthates se forment de façon similaire à partir d'alcoolates:
- RONa + CS2 -> [Na+][ROCS2-]
Cette réaction est le point de départ de la fabrication de cellulose réarrangée, principal composant de la rayonne viscose et du cellophane. Les xanthates et leurs équivalents soufrés les thioxanthates (dérivé d'un traitement de CS2 par des thiolates de sodium) sont utilisés comme agents de flottation dans le traitement de certains minerais. La réaction avec le sulfure de sodium donne l'ion trithiocarbonate:
- Na2S + CS2 -> [Na+]2[CS32-]
Réduction
Le sodium réduit CS2 et donne l'hétérocycle "dmit2-" :[6]
-
- 3 CS2 + 4 Na -> Na2C3S5 + Na2S
Une réduction électrochimique directe donne l'anion tétrathiooxalate:[7]
-
- 2 CS2 + 2e- -> C2S42-
Chloration
La production de tétrachlorure de carbone à partir de CS2 est la voie de synthèse majoritairement employée :[5]
Cette conversion passe par l'intermédiaire thiophosgène, CSCl2.
Chimie de coordination
CS2 est un ligand impliqué dans de nombreux complexes, formant des recouvrements de type Pi. Par exemple CpCo(η²-CS2)(PMe3).[8]
Effets sur la santé
A des niveaux élevés, le sulfure de carbone peut être mortel car il touche le système nerveux. Ce point est critique dans l'industrie de la rayonne viscose où il est présent en plus du sulfure d'hydrogène lui aussi toxique.
Notes et références
- ↑ a , b , c , d , e , f , g , h , i et j DISULFURE DE CARBONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « disulfure de carbone » sur ESIS, consulté le 18 février 2009
- ↑ « Disulfure de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ (en)Girolami, G. S.; Rauchfuss, T. B. and Angelici, R. J., Synthesis and Technique in Inorganic Chemistry, University Science Books: Mill Valley, CA, 1999.ISBN 0-935702-48-2
- ↑ (en)Jeroschewski, P. "Electrochemical Preparation of Tetraalkylammonium Salts of Tetrathiooxalic Acid" Zeitschrift für Chemie (1981), volume 21, 412.
- ↑ (en)Werner, H. "Novel Coordination Compounds formed from CS2 and Heteroallenes" Coordination Chemistry Reviews, 1982, volume 43, pages 165-185. {DOI| 10.1016/S0010-8545(00)82095-0}
Voir aussi
Articles connexes
Liens et documents externes
- (en) National Pollutant Inventory: Carbon disulfide
- (fr) Fiche toxicologique de l'INRS
- (fr) Fiche Toxicologique Internationale
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique facilement inflammable | Solvant | Sulfure | Composé du carbone
Wikimedia Foundation. 2010.



