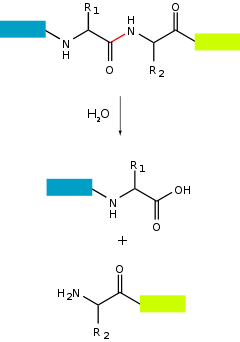- Endoprotéase
-
Peptidase
Les peptidases (ou protéases ou enzymes protéolytiques) sont des enzymes qui brisent les liaisons peptidiques des protéines. On parle alors de coupure protéolytique ou de protéolyse. Ce processus implique l'utilisation d'une molécule d'eau ce qui les classe parmi les hydrolases.
Les fonctions biologiques des protéases sont variées : elles interviennent dans la maturation des protéines, dans la digestion des aliments, dans la coagulation sanguine, dans le remodelage des tissus au cours du développement de l'organisme et dans la cicatrisation. Certaines protéases sont des toxines, comme la toxine botulique.
Certaines protéases sont produites sous forme de précurseurs inactifs, appelés zymogènes. Ils sont en général activés par une coupure protéolytique qui libère l'enzyme fonctionnelle et déclenche ainsi l'activité. Il existe ainsi des processus de protéolyse en cascade, en particulier dans la coagulation.
Sommaire
Classification fonctionnelle
Il existe différentes familles fonctionnelles de peptidases, qui sont classées en fonction de la position où a lieu la coupure dans la chaîne peptidique :
- Les exopeptidases
- Les aminopeptidases qui coupent entre le premier acide aminé et le second acide aminé de la chaîne, libère donc l'acide aminé N-terminal
- Le carboxypeptidases qui coupent entre l'avant dernier et le dernier acide aminé de la chaîne, libère donc l'acide aminé C-terminal
- Les endoprotéases qui peuvent couper à l'intérieur de la chaîne peptidique
La plupart des peptidases clivent préférentiellement la chaîne peptidique à des positions précises, en fonction de la nature des chaînes latérales des acides aminés qui entourent le site de coupure. Dans certains cas, cette spécificité est faible, mais dans d'autres, elle peut être très sélective. La coupure peut aussi être influencée par la structure de la protéine substrat. Ainsi la chymotrypsine, enzyme digestive, coupe préférentiellement après les acides aminés aromatiques ou aliphatiques.
Mécanisme d'action
Plusieurs mécanismes d'action ont été décrits pour les protéases, ce qui permet de les regrouper en grandes familles mécanistiques, en fonction de la nature du ou des acides aminés du site actif impliqué dans la catalyse. On distingue ainsi :
- Les protéases à sérine qui possèdent une triade catalytique caractéristique comprenant une sérine (d'ou leur nom), une histidine et un aspartate. Le groupement hydroxyle de la sérine joue le rôle de nucléophile et attaque le carbonyle de la liaison peptidique. Parmi les protéases à sérine, on peut citer :
- la trypsine du pancréas (EC 3.2.21.4), spécifique des liaisons peptidiques dans lesquelles l’acide aminé engagé par son carboxyle est un lysine ou une arginine.
- la chymotrypsine (EC 3.4.21.1) du pancréas s’attaque à des liaisons peptidiques où le carboxyle engagé est un acide aminé hydrophobe ou aromatique.
- la thrombine qui clive le fibrinogène en fibrine lors de la coagulation sanguine.
- Les protéases à thiol qui possèdent une cystéine dans leur site actif. Dans ces protéases, le rôle du nucléophile est joué par le soufre de la cystéine, sous forme de thiolate déprotoné. Parmi les protéases à thiol, on peut citer :
- Les protéases acides agissent à pH acide et possèdent un acide aspartique sur leur site actif. Par exemple :
- la pepsine : spécifique des liaisons peptidiques dans lesquelles est engagé un acide aminé aromatique (fonction amine).
- la protéase du VIH-1.
- Les métalloprotéases qui possèdent un cation métallique, en général un atome de zinc, fixé fortement à la protéine par les chaînes latérales de plusieurs acides aminés. Le cation métallique intervient directement pour activer une molécule d'eau qui clive la chaîne peptidique. Par exemple :
- la thermolysine
- les protéases de la matrice extracellulaire.
- Les protéases à thréonine (ou Thréonine protéases)
- les protéases à acide glutamique
Les peptidases à thréonine et acide glutamique n'ont été décrites respectivement qu'en 1995 et 2004.
Occurrence
Les protéases sont des enzymes très abondantes dans le règne vivant. On trouve des protéases dans l'ensemble des organismes vivants et les gènes qui codent ces protéines peuvent constituer de 1 à 5% du contenu en gènes du génome.
Utilisation en biotechnologie
Des protéases purifiées sont utilisées pour des biotransformations : par exemple la présure de veau utilisée dans l'industrie du fromage contient des protéases digestives. Des protéases sont également utilisées dans les lessives pour dégrader les protéines présentes dans les taches.
Inhibiteurs de protéase
Il existe des molécules capables de bloquer l'activité des protéases que l'on appelle des inhibiteurs de protéase. Ces molécules ont souvent des propriétés pharmacologiques intéressantes, compte-tenu de la diversité des mécanismes physiologiques dans lesquels sont impliqués les protéases. Les modes de blocage sont variés, il peuvent aller d'un blocage par une autre protéine qui séquestre la protéase, à l'inactivation irréversible de résidus du site actif par un composé chimique (inhibiteur suicide), en passant par des analogues de peptides qui miment le substrat naturel.
Exemples d'inhibiteurs de protéases
- L'hirudine est une protéine produite par la sangsue (Hirudo medicinalis) qui empêche l'activité de la thrombine, protéase de la coagulation. Elle est utilisée par la sangsue comme anticoagulant lorsqu'elle suce une proie.
- Le PMSF (flurorure de phenylméthanesulfonyle) est un inhibiteur des protéases à sérine qui réagit de manière covalente avec la sérine du site actif. le PMSF et plusieurs inhibiteurs des protéases à sérines sont aussi des inhibiteurs des cholinestérases, ce qui en fait des produits neurotoxiques.
- Divers chélatants, comme l'EDTA, sont utilisés comme inhibiteurs de métalloprotéases. Ils agissent en séquestrant les ions métalliques indispensables à l'activité de ces enzymes.
Exemples de médicaments
- Voir les Inhibiteurs de protéases en pharmacologie: antiprotéases VIH-1, antirétroviraux
- Captopril : inhibiteur de l'enzyme de conversion de l'angiotensine, antihypertenseur
- racécadotril ( marque commerciale : Tiorfan) : inhibiteur de l'enképhalinase intestinale, antidiarrhéique [1].
Voir aussi
Liens externes
MEROPS en:base de donnée des peptidases
- Portail de la biologie
- Portail de la biochimie
- Portail de la chimie
Catégorie : EC 3.4 - Les exopeptidases
Wikimedia Foundation. 2010.