- Enthalpie de changement d'état
-
L'enthalpie de changement d'état d'un corps pur est par définition la variation d'enthalpie ΔH = H2 - H1 qui accompagne le passage du système d'un état physique 1 à un état physique 2. On définit l'enthalpie de changement d'état molaire ou massique.
L'enthalpie de changement d'état, molaire ou massique, est la quantité de chaleur nécessaire à l'unité de quantité de matière (mole) ou de masse (kg) d'un corps pur pour qu'il change d'état, cette transformation ayant lieu à pression constante. Par exemple pour le passage de l'état liquide à l'état de vapeur on parlera d'enthalpie de vaporisation.
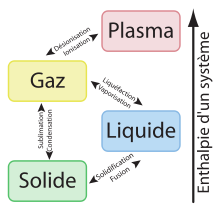
L'enthalpie échangée lors du changement d'état résulte de la modification (rupture ou établissement) de liaisons interatomiques ou intermoléculaires. Il existe trois états physiques principaux pour tout corps pur: l'état solide, l'état liquide et l'état gazeux. Les liaisons sont plus fortes dans l'état solide que dans l'état liquide et ces liaisons sont quasi-absentes dans l'état gazeux. Il existe un quatrième état obtenu à très haute température où la matière se trouve sous la forme d'un plasma d'ions et d'électrons.
Par exemple, l'eau bout à 100 °C sous la pression d'1 atmosphère ( 1atm = 101325 Pascal). L'enthalpie de vaporisation de l'eau, égale à la quantité de chaleur fournie pour transformer l'eau liquide en vapeur, est de 2257 kJ/kg.
Le changement d'état s'effectuant à pression p constante, la quantité de chaleur échangée avec le milieu extérieur lors du passage de l'état 1 à l'état 2 est Qp1,2 = ΔH1,2 (voir enthalpie). Qp1,2 est encore parfois appelée chaleur latente de changement d'état ; l'adjectif « latente » indique que cette quantité est « cachée » avant d'être absorbée ou dégagée lors du changement d'état. À l'expression « chaleur latente de changement d'état » (molaire ou massique), on préfère aujourd'hui celle d'« enthalpie de changement d'état » (molaire ou massique).
Changement d'état
Au cours d'un changement d'état d'un corps pur, il y a une variation d'enthalpie et d'entropie du corps. Par exemple pour un corps de masse m passant de l'état 1 à l'état 2 à la température T0
- ΔH1,2 = mL1,2 et

 Chaleur latente massique exprimée en J/kg
Chaleur latente massique exprimée en J/kg- ΔH1,2 Variation d'enthalpie en J
- ΔS1,2 Variation d'entropie en J/K
- m masse en kg
- T0 Température en K
La chaleur latente massique de fusion des métaux est comprise entre 4 et 16 kJ/kg, sauf rare exception. Cette règle permet de connaître une valeur approchée de l'enthalpie de fusion, connaissant la température de fusion :

 chaleur latente massique exprimée en J/kg
chaleur latente massique exprimée en J/kg variation d'entropie molaire lors de la fusion en J/(mol.K)
variation d'entropie molaire lors de la fusion en J/(mol.K) température de fusion en K
température de fusion en K masse en kg
masse en kgEnthalpie de fusion
Article détaillé : Enthalpie de fusion.L'enthalpie de fusion est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état liquide à température et pression constantes.
L'enthalpie de solidification (transformation inverse de la précédente) est l'opposée de l'enthalpie de fusion :
ΔH (solidification) = - ΔH (fusion)
Enthalpie de vaporisation
Article détaillé : Enthalpie de vaporisation.L'enthalpie de vaporisation d'un composé chimique est la différence d'enthalpie mise en jeu lors de la vaporisation d'une mole de ce composé.
L'enthalpie de liquéfaction (transformation inverse de la précédente) est l'opposée de l'enthalpie de vaporisation :
ΔH (liquéfaction) = - ΔH (vaporisation)
Enthalpie de sublimation
Article détaillé : Enthalpie de sublimation.L'enthalpie de sublimation, ou chaleur latente de sublimation, est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état gazeux à température et pression constantes.
L'enthalpie de condensation (transformation inverse de la précédente) est l'opposée de l'enthalpie de sublimation :
ΔH (condensation) = - ΔH (sublimation)
Histoire
On nommait autrefois chaleur latente cette grandeur, en référence à la vision substantialiste de la chaleur (considérée comme un fluide, une substance, immatérielle) qui était largement répandue jusqu'au XIXe siècle avec notamment les travaux de Joseph Fourier sur cette dernière.
Voir aussi
- Chaleur massique
- Règle de Trouton (calcul empirique de l'enthalpie de vaporisation)
- Formule de Clapeyron
- Chaleur
- Calorimétrie
Références
"Carburants et moteurs", J-C Guibet, Publication de l'Institut Français du Pétrole, ISBN 2-7108-0704-1
"Dictionnaire de physique expérimentale Quaranta", Tome II, Thermodynamique et Applications, Éditions Pierron, 1997, ISBN 2-7085-0168-2
- ΔH1,2 = mL1,2 et
Wikimedia Foundation. 2010.