- 1303-00-0
-
Arséniure de gallium
Arséniure de gallium 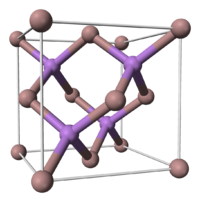
Général Nom IUPAC Arséniure de gallium No CAS No EINECS SMILES InChI Apparence solide gris sombre Propriétés chimiques Formule brute GaAs Masse molaire 144,645 g∙mol-1
As 51,8 %, Ga 48,2 %,Propriétés physiques T° fusion 1 239,9 °C Masse volumique 5 318 kg∙m-3 Propriétés électroniques Bande interdite 1,424 eV Mobilité électronique à 300 K : 9 200 cm²/(V·s) Mobilité des trous à 300 K : 400 cm²/(V·s) Masse effective de l'électron 0,067 me Masse effective du trou léger 0,082 me Masse effective du trou lourd 0,45 me Cristallographie Structure type blende Paramètres de maille 0,56533 nm Précautions NFPA 704 Autres infos toxique, se décompose en Arsenic (très toxique) Classification du CIRC Groupe 1 : Cancérogène pour l'homme[1] Unités du SI & CNTP, sauf indication contraire. L'arséniure de gallium (GaAs) est un composé chimique d’arsenic et de gallium.
C'est un matériau semi-conducteur utilisé en particulier pour réaliser des composants micro-ondes et des composants opto-électroniques, diodes électro-luminescentes infrarouge ou des cellules photovoltaïques. Le GaAs est un semi-conducteur dit « III-V » car le gallium et l’arsenic sont respectivement dans les colonnes III et V dans le tableau de classification périodique des éléments, et présentent donc 3 et 5 électrons de valence.
Sommaire
Structure cristalline
L'arséniure de gallium possède une structure cristalline de type blende. Si l'on considère que les atomes de gallium suivent une structure de type cubique à faces centrées (CFC), les atomes d'arsenic occupent quant à eux 4 des 8 sites tétraédriques de cette maille (et vice-versa).
Comparaisons GaAs-Silicium
Atouts de l'arséniure de gallium
L'arséniure de gallium a quelques propriétés électriques supérieures à celles du silicium :
- il possède une plus grande vitesse de saturation des électrons, et ceux-ci ont une mobilité plus grande, ce qui lui permet de fonctionner à des fréquences supérieures à 250 GHz ;
- les dispositifs à technologie GaAs génèrent moins de bruit en hautes fréquences que ceux à base de silicium ;
- ils peuvent de même fonctionner à puissance plus élevées, du fait d'une tension de claquage plus élevée.
Ces propriétés font de l'arséniure de gallium un composé de choix, notamment dans la fabrication de circuits pour téléphones portables, communications par satellite, technologie micro-onde, ainsi que certains dispositifs à radar. L'arséniure de gallium est aussi utilisé dans la fabrication de diode Gunn.
Un autre atout de l'arséniure de gallium est son gap direct (contrairement au silicium qui a lui un gap indirect) ce qui lui permet d'émettre de la lumière (le silicium émet très peu de lumière, même si de récentes avancées technologiques ont permis de l'utiliser pour faire des LEDs ou des lasers).
Les propriétés de l'arséniure de gallium, en particulier sa vitesse de commutation, l'on fait paraître comme un matériau idéal, notamment pour des applications en informatique. Dans les années 1980, beaucoup pensaient que le marché de la microélectronique serait dominé à terme par l'arséniure de gallium, remplaçant ainsi le silicium. La première tentative d'évolution est due aux vendeurs de superordinateurs Cray Research, Convex, et Alliant. Cray développa une machine à base d'arséniure de gallium, le cray-3, mais les efforts financiers de recherche furent insuffisants, et la compagnie fit faillite en 1995.
Atouts du silicium
Le silicium possède trois principaux avantages vis-à-vis de l'arséniure de gallium.
Tout d'abord il est particulièrement abondant (élément le plus abondant sur Terre après l'oxygène). Plus robuste, il permet de faire des pastilles plus grandes (~300 mm comparé à ~150 mm pour l'arséniure de gallium).
Le second avantage du silicium est l'existence d'un des ses oxydes, le dioxyde de silicium (SiO2), sans doute l'un des meilleurs isolants existant. Cet isolant peut être facilement incorporé aux circuits de silicium, et ces couches isolantes adhèrent bien aux couches de silicium. L'arséniure de gallium ne possède pas ce genre d'oxyde naturel aux propriétés équivalentes.
Le troisième est sans doute le plus important. Le ratio mobilité des trous / mobilité des électrons dans le silicium est de loin supérieur à celui de l'arséniure de gallium. En effet si la mobilité des électrons est largement supérieure dans l'arséniure de gallium que dans le silicium, celle des trous n'est pas du même ordre de grandeur (quoique légèrement supérieure à celle du silicium). Cette grande différence de mobilité entre trous et électrons dans l'arséniure de gallium rend difficile la fabrication de transistors à effet de champ-canal P de rapidité comparable aux transitors FET canal-N, ce qui gêne la mise en œuvre de la technologie CMOS, alors que le silicium, avec une différence bien moins grande n'a pas ce problème. C'est la raison pour laquelle l'arséniure de gallium n'a jamais pu être vraiment compétitif vis-à-vis du silicium.
Notes et références de l'article
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
Voir aussi
Articles connexes
Liens et documents externes
- Portail de la chimie
- Portail de la physique
Catégories : Composé de l'arsenic | Composé du gallium | Produit chimique qui réagit avec l'eau | Matériau semi-conducteur
Wikimedia Foundation. 2010.

