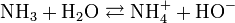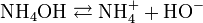- 1336-21-6
-
Ammoniaque
Ammoniaque Général Nom IUPAC solution aqueuse
d'hydroxyde d'ammoniumNo CAS No EINECS No E E527 Apparence solution tres volatile, incolore, d'ammoniac dans l'eau, d'odeur âcre.[1] Propriétés chimiques Formule brute NH4OH Masse molaire 35,0458 g∙mol-1
H 14,38 %, N 39,97 %, O 45,65 %,Propriétés physiques T° fusion (25%) -58 °C[1] T° ébullition (25%) 38 °C[1] Solubilité dans l'eau : miscible[1] Masse volumique (eau = 1) : (25%) 0.9[1] Pression de vapeur saturante à 20 °C : (25%) 48 kPa[1] Précautions Directive 67/548/EEC 
C
NPhrases R : 34, 50, Phrases S : (1/2), 26, 36/37/39, 45, 61, Transport 80 2672 SIMDUT[2] 
SGH[3] 

DangerUnités du SI & CNTP, sauf indication contraire. L'ammoniaque, ou hydroxyde d'ammonium, (NH4OH) est une solution aqueuse formée à partir d'ammoniac (NH3), qui est un gaz à l’odeur extrêmement irritante.
Sommaire
Description
L'ammoniac en solution réagit avec l'eau selon l'équilibre suivant :
Et l'hydroxyde d'ammonium (NH4OH) formé se dissocie comme suit :
On voit qu'il y a libération d'ions hydroxyde (HO-), qui confèrent à la solution d'ammoniac son caractère basique (au sens d'Arrhenius). Le pKa (constante de dissociation) du couple NH4+/NH3 est de 9,2 seulement : l'ammoniaque est une base faible.
Si l'ammoniaque n'est pas un produit dangereux, il est néanmoins très volatil, le gaz libéré (l'ammoniac) est extrêmement irritant et peut provoquer de vives douleurs. De plus, son mélange avec l'iode peut présenter des caractères explosifs. Mis en présence de platine (catalyseur), l'ammoniac se transforme en acide nitrique.
L'ammoniaque ne peut pas être conservé pendant une longue durée. Il doit être entreposé si possible dans des flacons de petite taille, bien fermés, car il réagit avec le dioxyde de carbone (CO2) atmosphérique et donne du carbonate d'ammonium en modifiant le pH de la solution. Ce phénomène abaisse la concentration de la solution en ammoniaque (phénomène commun à toutes les solutions basiques).
In vivo l'ammoniaque est transporté de façon non toxique par un acide aminé, l'acide glutamique, qui subit une condensation et « porte » le groupement NH3+ en donnant un amide : la glutamine. La glutamine transporte l'ammoniaque sans être toxique jusqu'aux reins et/ou au foie où il peut intervenir dans le cycle de l'urée.
Notes et références de l'article
- ↑ a , b , c , d , e et f HYDROXYDE D'AMMONIUM (solution 10% - 35%), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Hydroxyde d'ammonium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Articles connexes
Liens et documents externes
- L'ammoniac et ses solutions aqueuses, fiche toxicologique INRS.
- Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Amine | Composé de l'ammonium | Hydroxyde
Wikimedia Foundation. 2010.