- Hydroxyde de sodium
-
 Pour les articles homonymes, voir soude (homonymie).
Pour les articles homonymes, voir soude (homonymie).Hydroxyde de sodium 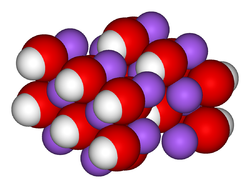
__ Na+ __ HO−
Structure du réseau cristallin de l'hydroxyde de sodium.Général Nom IUPAC Hydroxyde de sodium No CAS (anhydre)
(·H2O)
(·H2O)No EINECS (anhydre)
(·H2O)PubChem No E E524 SMILES InChI Apparence solide de formes variables, blanc, déliquescent, inodore[1]. Propriétés chimiques Formule brute NaOH Masse molaire[2] 39,9971 ± 0,0004 g·mol-1
H 2,52 %, Na 57,48 %, O 40 %,pKa Base forte Propriétés physiques T° fusion 318 °C[1] T° ébullition 1 390 °C[1] Solubilité dans l'eau à 20 °C : 1 090 g·l-1[1] Masse volumique 2,1 g·cm-3[1] Pression de vapeur saturante 0,13 kPa à 739 °C
2,67 kPa à 953 °C
13,3 kPa à 1 111 °C
53,3 kPa à 1 286 °CThermochimie ΔvapH° 175 kJ·mol-1 (1 atm, 1 388 °C)[3] Précautions Directive 67/548/EEC[4] 
CPhrases R : 35, Phrases S : 1/2, 26, 37/39, 45, Transport 80 1823
80 1824 NFPA 704 SIMDUT[5] 
SGH[6] 
DangerPeau Irritant Yeux Irritant Composés apparentés Cations apparentés Hydroxyde de potassium Unités du SI & CNTP, sauf indication contraire. L'hydroxyde de sodium est un solide ionique de formule statistique NaOH. La solution issue de la dissolution de ce cristal est appelée soude, voire soude caustique[7].
La solution aqueuse d'hydroxyde de sodium peut être vendue sous le nom de « lessive de soude ». Ce produit est assez courant dans le commerce, présenté comme déboucheur de canalisations.
L'hydroxyde de sodium se présente généralement sous la forme de pastilles ou de billes blanches, corrosives et hygroscopiques.
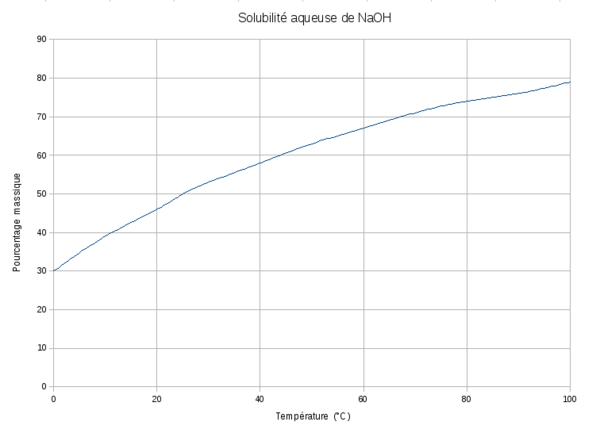
L'hydroxyde de sodium est très soluble dans l'eau et soluble dans l'éthanol[8]. Sa dose journalière admissible est non spécifiée depuis 1965[8].
La soude est une solution chimique transparente et corrosive.
L'ion hydroxyde est une base forte.
Sommaire
Techniques de fabrication
Historique
Dans l'Antiquité, on utilisait la soude végétale. La soude, mot qui désignait alors le carbonate de sodium, provenait des cendres obtenues par la combustion de plantes halophytes comme la salicorne ou les Soudes. La soude caustique est ensuite obtenue par caustification (voir ci-dessous). En 1791, le chimiste Nicolas Leblanc invente un procédé permettant d'obtenir du carbonate de sodium à partir d'eau de mer, procédé qui sera supplanté par le procédé Solvay en 1861 (de Ernest Solvay). Ces procédés permettent de réduire les coûts de revient de la soude. À la fin du XIXe siècle l'avènement de l'électricité permet la production directe de soude par électrolyse d'une solution de chlorure de sodium. Aujourd'hui 99 % de la soude produite est d'origine électrochimique.
Électrolyse de saumure (eau saturée en sel)
La soude est obtenue par électrolyse du chlorure de sodium NaCl.
La soude s'obtient pour le moment majoritairement par une électrolyse avec cathode de mercure (anode : titane ; cathode : mercure). Cette opération produit en même temps du chlore, de la soude et de l'hydrogène. Mais le mercure est un métal lourd nocif par bioaccumulation et à très faible dose, plus encore lorsqu'il est transformé en mono- ou di-méthylmercure par les bactéries. Il est volatil et non dégradable, et passe facilement la barrière des poumons, ce qui en fait un des polluants majeurs de l'environnement, en augmentation dans toutes les mers. C'est l'une des raisons pour laquelle les sociétés européennes impliquées se sont engagées à faire disparaître ce procédé à l'horizon 2020, procédé en cours de remplacement par des électrolyses à membranes[9].
Il existe un autre procédé : électrolyse à diaphragme, qui comportait de l'amiante, substituée en France par un matériau composite depuis la fin des années 1990.
À partir de carbonate de sodium
Cette technique était celle utilisée autrefois. Elle est encore utilisée en Amérique du Nord où se trouvent des gisements naturels de carbonate de sodium. C'est un ajout de chaux (matière) au carbonate de sodium. On parle de caustification ou de caustication. La réaction s'écrit :
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOHFabrication de la chaux :
Par calcination du calcaire (CaCO3) vers 900 °C on obtient de la chaux vive (oxyde de calcium : CaO) et un faible dégagement de dioxyde de carbone (CO2):
La réaction s'accompagne d'une perte de masse d'environ 45 %, correspondant à la perte en dioxyde de carbone selon la formulation chimique suivante :
CaCO3 → CaO + CO2
La transformation de chaux vive en chaux éteinte, s'effectue par ajout d'eau (H2O). Cette opération d'extinction produit l'hydroxyde de calcium Ca(OH)2 avec un fort dégagement de chaleur :
Utilisations
- L'hydroxyde de sodium est utilisé en grande quantité par plusieurs industries, principalement en tant que base notamment pour la fabrication des pâtes et papiers, de produits chimiques et plastiques, du savon et de produits détergents en général, de certains textiles artificiels, de l'aluminium (traitement de la bauxite). La soude sert à réguler le pH et régénérer les résines échangeuses d'ions des stations de traitement des eaux.
- En agro-alimentaire elle sert à nettoyer les installations (circuits, bouteilles), modifier l'amidon, épluchage chimique, etc. C'est aussi un additif alimentaire (E524[10]), il sert comme régulateur de l’acidité[11] et il est utilisé dans une large gamme de produits[12].
- Les déboucheurs chimiques sont souvent à base d'hydroxyde de sodium.
- La production mondiale de 1998 était d'environ 45 millions de tonnes. L'hydroxyde de sodium est la base la plus communément utilisée en laboratoire.
- La soude peut être utilisée pour stocker de l'énergie solaire sous forme chimique. En effet, la réaction entre la soude et l'eau est fortement exothermique. Une fois la soude diluée, il suffit d'utiliser directement l'énergie solaire pour faire s'évaporer l'eau et revenir à l'état initial.
- La soude est également utilisée comme un réactif pour des tests de chimie. En effet, en présence de certains cations métalliques, la soude forme un précipité d'une certaine couleur.
- La réaction de l'hydroxyde de sodium avec l'eau et l'aluminium produit un dégagement d'hydrogène qui peut faire fonctionner un moteur à explosion sans émission de CO2.
cation métallique couleur du précipité Cu2+ bleu Fe2+ vert Fe3+ rouille Zn2+ blanc Al3+ blanc Ag+ blanc - La soude est utilisée dans certains produits défrisants pour cheveux, mais a tendance à être abandonnée dans les cosmétiques modernes.
Effets sur la santé
 Brûlure chimique après exposition à une solution d'hydroxyde de sodium.
Brûlure chimique après exposition à une solution d'hydroxyde de sodium.
L'hydroxyde de sodium réagit violemment avec l'eau en quantité appréciable seulement, risquant ainsi de provoquer des éclaboussures dangereuses. Lorsqu'il est mélangé avec de l'eau, la température du mélange augmente jusqu'à atteindre une température proche de celle du point d'ébullition de l'eau, soit 100 °C. La soude caustique est irritante et corrosive pour la peau, les yeux, les voies respiratoires et digestives. Elle doit être manipulée avec des gants, des lunettes de protection et une protection des voies respiratoires. En cas de contact avec la peau, épongez avec du vinaigre[13] , puis rincez abondamment (15 à 20 minutes) avec de l'eau[14], retirez les vêtements imprégnés en évitant de propager le contact de la base avec la peau, et consultez un médecin.
En cas d'ingestion accidentelle, il ne faut pas faire vomir à cause du risque de double brûlure (aller et retour). Il faut appeler les secours ou un centre anti-poison le plus vite possible.
En cas de contact avec les yeux il faut rincer abondamment pendant au moins 20 minutes sous l'eau courante, si vous avez des kits de neutralisation des bases, il est fortement recommandé de les utiliser, et ensuite consulter un médecin ophtalmologiste[14].
Effets sur l'environnement
La soude caustique augmente le pH des cours d’eau, représentant ainsi une menace potentielle pour la faune et la flore aquatique.
La soude caustique ne doit pas être confondue avec le bicarbonate de sodium, ni avec le carbonate de sodium.
La soude caustique s'infiltre dans la terre, peut nuire à l'agriculture comme à l'environnement des végétaux, des minéraux et des animaux proches ou lointains (rivière, fleuve, nappe phréatique).
Notes et références
- HYDROXIDE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0)
- ESIS. Consulté le 6 décembre 2008
- « Hydroxyde de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- L'appellation Soude caustique n'est apparue que pour la différencier du carbonate de soude (Na2CO3), jadis appelé également soude.
- (en) [PDF] FAO Monograph 1 (2006) SODIUM HYDROXIDE INS number: 524
- (en) http://ec.europa.eu/environment/chemicals/mercury/pdf/report.pdf Rapport final de la Commission Européenne sur le Cycle du Mercure, février 2004
- Parlement européen et Conseil de l'Europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56 [texte intégral (page consultée le 19/05/2008)]. [PDF]
- Noms de catégorie et système international de numérotation des additifs alimentaires, CAC/GL 361989 sur http://www.codexalimentarius.net, Codex alimentarius, 1989, p. 1-35. Consulté le 14/09/2008. [PDF]
- (en)Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Sodium hydroxide (524) », GSFA Online sur http://www.codexalimentarius.net, Codex Alimentarius, 2008. Consulté le 3/10/2008.
- Évaluation de la toxicité des matières premières
- Fiche CSST, premiers secours
Voir aussi
Articles connexes
- Composés apparentés :
- peu connus :
Liens externes