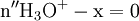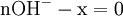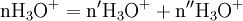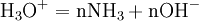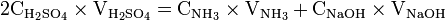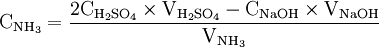- Kjeldahl
-
Méthode de Kjeldahl
La méthode de Kjeldahl est applicable pour le dosage de l’azote de différents composés azotés tels les amines et les sels d’ammonium quaternaires. Elle ne permet pas le dosage direct des nitrates, nitrites, nitrosyles, cyanures qu’il faut d’abord réduire en ammoniac.
Quand l’azote est sous forme organique, il faut d’abord procéder à la minéralisation du composé pour passer à de l’azote minéral. On détruit la molécule organique en l’oxydant à ébullition par H2SO4 concentré, en présence de catalyseur : le carbone s'élimine sous forme de CO2, l’hydrogène sous forme de H2O et l’azote reste en solution sous forme de
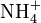 .
.Sommaire
Historique
C'est en 1882 que Johan Kjeldahl mit au point cette méthode qui porte désormais son nom.
Principe
En milieu basique concentré, le produit minéral, dont on veut doser l’azote, libère de l’ammoniac sous forme gazeuse.
Par exemple si le produit à doser est le tétrafluoroborate d'ammonium (
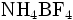 ), on a :
), on a :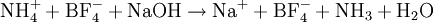
NH3 est entraîné à la vapeur d’eau. Les vapeurs d’ammoniac sont condensées au contact d’un réfrigérant et recueillies dans une quantité connue et en excès d’acide fort.
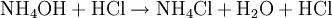 en excès
en excèsOn titre l’excès d’acide par une solution titrée de soude :
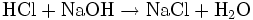
Exemple : dosage de l'azote total du lait
Le lait contient entre 32 et 35 g/L de matière organique azotée dont 95% de l'azote se trouve dans les protéines et les 5% restant dans des acides aminés libres.
Mode opératoire
Minéralisation
Pour doser les protéines contenues dans du lait par cette méthode, il faut d'abord procéder à une minéralisation. Pour cela introduire dans un matras :
- 2 mL de lait exactement mesuré ;
- 15 à 20 mL d'acide sulfurique concentré ;
- 6 g de sulfate de potassium ;
- 1 g de sulfate de cuivre ;
- quelques grains de pierre ponce.
Porter à ébullition la solution sous une hotte ventilée (les vapeurs de la minéralisation sont très irritantes et toxiques). Puis, à partir de l'éclaircissement de la solution, prolonger l'ébullition une demi-heure.
Laisser refroidir et introduire avec précaution de 30 à 50 mL d'eau distillée.
Récupération de l'ammoniac
Réaliser le montage de distillation suivant :
Montage à réaliser, voir l'article Distillation
Dans le ballon, introduire :
- le contenu du matras (voir ci-dessus) soigneusement rincé (pour en extraire tous les composés azotés ; compléter à 250 mL avec de l'eau distillée ;
- quelques gouttes de phénolphtaléine ;
- de l'hydroxyde de sodium à 400 g/L jusqu'à ce que le contenu du ballon devienne rose.
Plonger le bout du réfrigérant dans un bécher contenant 20 mL d'acide borique et 2-3 gouttes de rouge de méthyle.
Chauffer modérément le ballon.
Doser l'ammoniac, au fur et à mesure de son dégagement, par une solution titrée d'acide sulfurique à 0 05 mol/L. Le dosage est terminé dès que la coloration reste stable pendant environ 5 min.
Par précaution, retirer le bécher avant de stopper le chauffage pour éviter tout siphonnage.
Calculs
x représente l'avancement de la réaction. Dans la première réaction, l'ammoniac est mis en présence d'un excès d'acide où une partie n' de l'acide réagit. On fait réagir le restant de l'acide n avec la soude. nH3O + = n' + n'', c'est un dosage en retour.
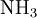
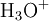
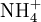
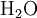
Etat initial 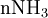
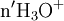
excès État intermédiaire 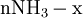
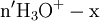
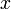
excès État Final 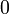
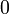
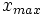
excès 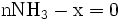
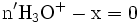
- donc
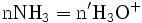
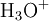
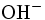
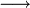
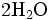
État initial 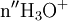
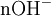
État intermédiaire 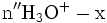
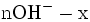
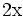
État Final 
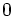
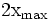
donc
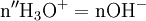
Une mole de NH3 provient d'une mole d'atomes d'azote (N). Donc en retrouvant le nombre de moles d'atomes d'azote vous pourrez en déterminer la concentration massique.
Voir aussi
- Johan Kjeldahl
- Méthode de Biuret méthode colorimétrique du dosage de l'azote.
- Portail de la chimie
Catégories : Chimie analytique | Réaction chimique
Wikimedia Foundation. 2010.