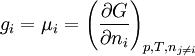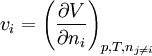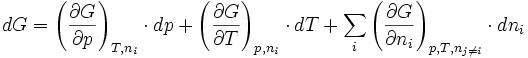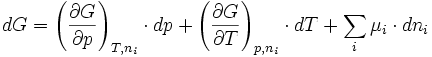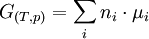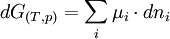- Potentiels chimiques
-
Potentiel chimique
Sommaire
Le potentiel chimique
Définition
Le potentiel chimique d'un constituant physico-chimique i, dans un système réactionnel est égal, par définition, à la dérivée partielle de l'enthalpie libre du système par rapport à la quantité de matière ni de ce constituant; les autres variables du système étant constantes:
Il s'agit en fait d'une grandeur molaire partielle (comme par exemple le volume molaire partiel)Le potentiel chimique correspond à l'enthalpie libre molaire partielle :gi.
Expression de la différentielle de l'enthalpie libre d'un système réactionnel
La fonction enthalpie libre G est une fonction d'état donc sa différentielle totale est exacte c'est à dire qu'elle est égale à la somme des différentielles partielles par rapport à chaque variable:
or
d'où
ou encore
or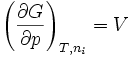 et
et 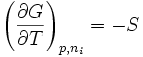
En résumé: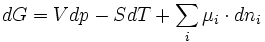 (1)
(1)Autres expressions du potentiel chimique
De la relation précédente on déduit, grâce aux relations G = H-TS, H = U+pV et F = U-TS que:
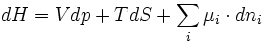
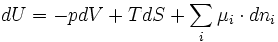
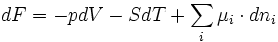
Avec respectivement
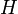 l'enthalpie,
l'enthalpie, 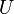 l'énergie interne et
l'énergie interne et 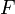 l'énergie libre.
l'énergie libre.On en déduit ainsi d'autres définitions équivalentes du potentiel chimique:
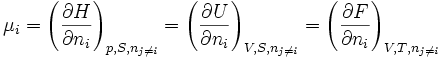
Ces définitions ne sont pas aussi importantes que la première car les réactions chimiques sont étudiées en général à T et pression constante (cas des réactions effectuées en contact avec la pression atmosphérique); les variables T et p présentent donc un intérêt plus important.
Relation de Gibbs-Duhem
Identité d'Euler
L'enthalpie libre totale du système est reliée aux potentiels chimiques des constituants :
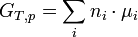 (2) (identité d'Euler)
(2) (identité d'Euler)
On démontre cette identité par le théorème d'Euler:
Soit un système 1 constitué de N constituants physico-chimiques Bi, de quantités de matières respectives ni, à la pression p et à la température T. Soit G1(T,p,ni) son enthalpie libre.
Soit un système 2, identique à 1, mais avec des quantités de matière
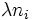 . Alors
. Alors 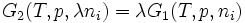 car G est une fonction d'état extensive. G1 est donc homogène de degré 1 par rapport a ni.
car G est une fonction d'état extensive. G1 est donc homogène de degré 1 par rapport a ni.Il s'ensuit :
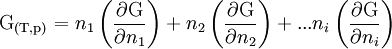
or
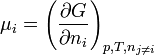
d'où l'identité d'Euler:
Relation de Gibbs-Duhem
On a vu précédemment (1) que la différentielle de G pouvait s'écrire:
or d'après (2), on a :
d'où
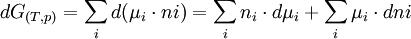 (3)
(3)
si la réaction a lieu à pression et à température constantes (dp = 0, dT = 0), on obtient
On obtient alors la relation de Gibbs-Duhem:à pression et température constantes : 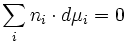
sinon : 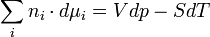
Cette relation est utile en particulier pour les mélanges binaires : on a, à T et p constantes, n1dµ1 + n2dµ2 = 0 ; donc si on peut connaître µ1, par diverses méthodes, on peut par intégration calculer µ2.Migration
Lorsqu'un milieu est hétérogène, l'activité chimique de chaque espèce n'est pas identique en chaque point du milieu et il en est de même pour le potentiel chimique, fonction de l'activité. Spontanément, chaque espèce va migrer vers les lieux où son potentiel chimique est le plus bas : l'enthalpie libre du système est ainsi minimisée, conformément au second principe de la thermodynamique.
Cette migration selon le gradient de potentiel chimique est complémentaire de la diffusion passive (loi de Fick) ; elle peut aller dans le même sens ou s'y opposer.
La précipitation et décomposition spinodale sont des exemples de migration sous un gradient de potentiel chimique.
Équilibre
Soit une espèce A présente dans deux phases. À l'équilibre, les potentiels chimiques de A dans les phases considérées sont égaux.
Par exemple, lorsqu'un liquide pur est en équilibre avec sa vapeur, on aura :
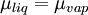 .
.On peut généraliser à une espèce présente dans N phases.
Voir aussi
Articles connexes
- Portail de la chimie
- Portail de la physique
Catégorie : Thermochimie
Wikimedia Foundation. 2010.