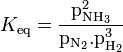- Procede de Haber
-
Procédé Haber
Le procédé Haber est un procédé chimique destiné à synthétiser de l'ammoniac (NH3) à partir du diazote (N2) gazeux atmosphérique et du dihydrogène (H2) gazeux en présence d'un catalyseur[1],[2],[3].
Le chimiste allemand Fritz Haber parvint, en 1909, à mettre au point un procédé chimique qui permettait d'extraire du diazote atmosphérique sous forme d'ammoniac liquide, c'est le procédé Haber[4],[2].
Une équipe de recherche de la société BASF parvint, en 1913, à mettre au point la première application industrielle du procédé Haber : c'est le procédé Haber-Bosch[5]. Le responsable de son industrialisation, Carl Bosch, agissait à la fois comme superviseur de l'équipe et comme concepteur, apportant des solutions originales à certains problèmes posés lors de sa mise au point[6],[7].
Le procédé Haber-Bosch a une importance économique considérable, car il est difficile de fixer l'azote, en grandes quantités et à un coût peu élevé, à l'aide des autres procédés mis au point. L'ammoniac ainsi obtenu sert le plus souvent à créer des engrais azotés synthétiques, lesquels sont essentiels pour alimenter le tiers de la population mondiale au début du XXIe siècle[8],[note 1]. Par exemple, le sel d'ammonium et le nitrate, obtenus à partir de l'ammoniac, servent à la fabrication de l'urée et du nitrate d'ammonium[9]. Le procédé a également une importance militaire certaine, car l'ammoniac peut être transformé en acide nitrique, précurseur de la poudre à canon et d'explosifs puissants (comme le TNT et la nitroglycérine)[10].
Quelques produits dérivés de l'ammoniac[9] Hydrazine Hydroxylamine ↑ ↑ Ammoniac → Monoxyde d'azote → Acide nitrique ↓ ↓ ↓ Sels d'ammonium Nitrites ← Nitrates ↓ ↓ Urée Nitrate d'ammonium Appareil de laboratoire utilisé par Fritz Haber pour synthétiser de l'ammoniac en 1909. Photographie prise en juillet 2009 au Musée juif de Berlin.
Sommaire
Histoire
Article principal : Histoire du procédé Haber-Bosch.Bien que l'atmosphère soit composée à 78,1% de diazote gazeux, il est chimiquement peu réactif car les atomes qui le composent sont reliés par une liaison covalente triple[11]. Même si l'azote est essentiel à la croissance des êtres vivants, toutes les plantes (à quelques exceptions près), tous les animaux et tous les humains sont incapables de l'assimiler directement[12]. Par contre, certaines bactéries sont capables de le fixer dans le sol ou dans les excréments, comme le guano, le rendant ainsi disponible comme engrais[11]. À partir des années 1820, le guano importé des îles Chincha permit aux agriculteurs européens d'améliorer notablement les rendements agricoles. Lorsque ces gisements furent épuisés vers la fin des années 1860, les minéraux en provenance du désert d'Atacama, chimiquement modifiés, permirent de maintenir les rendements agricoles[13]. En 1900, le Chili produisait les deux tiers de tous les engrais consommés sur la planète[12].
À partir de la moitié du XIXe siècle, plusieurs tentatives furent faites pour extraire le diazote de l'atmosphère, certaines obtinrent le succès. L'une des plus abouties fut le procédé Birkeland-Eyde exploité par Norsk Hydro : pendant la Première Guerre mondiale, cette société put produire annuellement jusqu'à 30 000 tonnes d'azote fixé[11]. Également, à partir des années 1850, l'industrie du charbon parvint à extraire l'ammoniac comme sous-produit lors de la fabrication du coke : elle fut le plus important producteur d'ammoniac avant la mise au point du procédé Haber-Bosch, moins coûteux[14].
 Fritz Haber. Photographie prise en 1918.
Fritz Haber. Photographie prise en 1918.
C'est en 1909 que Fritz Haber, avec l'aide de Robert le Rossignol[15], compléta la mise au point d'un prototype de laboratoire qui mettait en lumière les principes de ce qui est appelé le « procédé Haber ». Pour produire une quantité significative d'ammoniac selon l'équation chimique à l'équilibre :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH,
il faut déplacer son équilibre vers la droite. Pour y parvenir, il faut imposer une pression élevée, maintenir une température faible (puisque la réaction est exothermique), utiliser un catalyseur et retirer régulièrement de l'ammoniac. En pratique, la réaction est cependant très lente à de basses températures. Elle se fait donc à une température plus élevée (environ 450 °C) qui permet d'obtenir une quantité appréciable d'ammoniac dans un temps satisfaisant[16]. De plus, pour des raisons de coûts, la transformation des réactifs est incomplète (de l'ordre de 15 %), mais il est possible de recycler les réactifs qui n'ont pas réagi[17].
La société BASF, ayant acquis les droits sur le procédé en 1908[18], assigna à Carl Bosch la tâche de l'industrialiser[5]. Pour y parvenir, Bosch et ses collaborateurs durent résoudre plusieurs problèmes techniques de 1909 à 1913[7]. Par exemple, pour maintenir l'intégrité physique des appareils de production en cas de bris, il fallait que le système de production soit rapidement arrêté : ils mirent au point un ensemble d'instruments destinés à surveiller l'évolution en continu des réactions chimiques, une nouveauté à l'époque[19]. À cause de l'apport déterminant de Bosch à son industrialisation, il est aussi appelé « procédé Haber-Bosch ».
La première production industrielle d'ammoniac mettant en application le procédé Haber-Bosch débuta en 1913. Le site d'Oppau en Allemagne put produire 30 tonnes d'ammoniac par jour la même année[20]. En 1917, pendant la Première Guerre mondiale, BASF construisit un deuxième site, de capacité plus élevée, près de Mersebourg[5]. Le site de Leuna produisit 36 000 tonnes d'ammoniac en 1917, l'année d'après, c'était 160 000 tonnes. La presque totalité de sa production était destinée à l'armée allemande[21].
Après la guerre, plusieurs pays alliés confisquèrent les brevets de BASF sur le procédé Haber-Bosch[22]. Ce n'était cependant pas suffisant pour le maîtriser. Pour limiter les représailles après la Première Guerre mondiale, Carl Bosch fit un pacte avec les autorités françaises, promettant de révéler les secrets du procédé[23]. La société britannique Brunner Mond les acquit par espionnage industriel, alors que la société américaine Du Pont débauchat des techniciens senior de BASF[24]. Dans les années 1920, le Français Georges Claude[25], l'Italien Giacomo Fauser[26], l'Italien Luigi Casale[27] et l'Allemand Friedrich Uhde[28] développèrent chacun un procédé semblable à celui de Haber-Bosch.
En 1925, BASF devint membre d'IG Farben. Jusqu'en 1930, c'était le plus grand producteur mondial d'ammoniac synthétique. En 1927, il fabriquat environ 500 000 tonnes d'ammoniac. De 1929 à 1932, ce fut environ 1 million de tonnes par année[29].
En 2006-2007, la production mondiale d'engrais azotés a atteint environ 265 000 tonnes par jour[30].
Description
Le procédé Haber-Bosch consiste à favoriser la réaction exothermique de l'équation chimique à l'équilibre :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH
En génie chimique, cette réaction est réalisée en plusieurs étapes[31] :
- reformages (en amont du réacteur chimique) :
- purifier le dihydrogène ;
- éliminer les poisons catalytiques.
- synthèse (dans le réacteur chimique) :
- introduire du dihydrogène pur (H2(g)) ;
- introduire du diazote (N2(g)) ;
- synthétiser de l'ammoniac (NH3(g)) à l'aide de catalyseur.
- extraction (en aval du réacteur chimique) :
- séparer l'ammoniac des autres molécules (N2(g) et H2(g)) par liquéfaction ;
- recycler les molécules restantes.
- recycler la chaleur produite.
Pour parvenir à effectuer ces étapes de façon économique, il faut que le système de production[32] :
- fonctionne à des pressions de l'ordre de 200 atm ;
- fonctionne à des températures allant de 500 à 600 °C ;
- fasse circuler en permanence des gaz et des liquides sous haute pression ;
- recycle la chaleur produite.
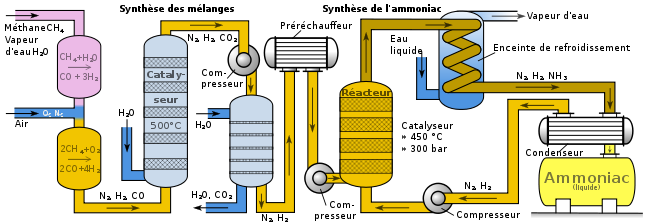 Diagramme sommaire montrant une application industrielle du procédé Haber-Bosch. Il expose les parties principales d'un site industriel, mais n'est pas nécessairement représentatif des sites réellement installés. Par exemple, Agarwal, dans un article sur la synthèse de l'ammoniac, a publié un diagramme, créé par Synetix, qui s'écarte sensiblement de celui-ci[33].
Diagramme sommaire montrant une application industrielle du procédé Haber-Bosch. Il expose les parties principales d'un site industriel, mais n'est pas nécessairement représentatif des sites réellement installés. Par exemple, Agarwal, dans un article sur la synthèse de l'ammoniac, a publié un diagramme, créé par Synetix, qui s'écarte sensiblement de celui-ci[33].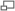
Reformages
Le méthane est purifié, surtout dans le but d'éliminer le soufre qui empoisonnerait les catalyseurs.
Le méthane purifié réagit ensuite avec de la vapeur d'eau lorsque mis en contact avec un catalyseur fait d'oxyde de nickel. C'est le processus de vaporéformage :
- CH4(g) + H2O(g) → CO(g) + 3 H2(g)
Un deuxième réformage suit en ajoutant de l'air dans le but de convertir le méthane qui n'a pas encore réagi pendant le vaporéformage :
- 2CH4 + O2 → 2 CO + 4 H2
- CH4 + 2 O2 → CO2 + 2 H2O
La réaction du gaz à l'eau permet d'obtenir plus d'hydrogène à partir du monoxyde de carbone et de la vapeur d'eau :
- CO + H2O → CO2 + H2
Le mélange gazeux passe alors dans un méthanateur, qui convertit la plupart du monoxyde de carbone restant en méthane :
- CO + 3 H2 → CH4 + H2O
Cette étape est nécessaire car le monoxyde de carbone empoisonne les catalyseurs.
À la fin de ces étapes, le méthane et une partie de la vapeur d'eau ont été transformés en dioxyde de carbone et en dihydrogène.
Synthèse de l'ammoniac
C'est pendant le procédé Haber proprement dit que survient la synthèse de l'ammoniac.
Le diazote et le dihydrogène réagissent sur un catalyseur de fer qui contient de l'hydroxyde de potassium comme accélérateur :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH, ΔHo = -92,4 kJ/mol à 25 °C
Cette réaction, à l'équilibre, est effectuée à une pression se situant entre 15 et 25 MPa et à une température allant de 300 à 550 °C. Les réactifs gazeux circulent sur quatre lits de catalyseurs. À chaque passage, environ 15 % des réactifs sont transformés, mais tous les réactifs qui n'ont pas réagi sont recyclés, ce qui permet d'atteindre un taux de conversion de 98 %. Après chaque passage, les réactifs sont refroidis pour maintenir une constante d'équilibre raisonnable.
Le vaporéformage, la réaction du gaz à l'eau, l'élimination du dioxyde de carbone et la méthanation surviennent à des pressions absolues se situant entre 2,5 et 3,5 MPa.
En développant son procédé, Haber mis au point la technique du recyclage des réactifs inutilisés[20]. Si les réactifs sont mis en présence une seule fois, les paramètres de l'équation chimique à l'équilibre ne donnent pas un taux de conversion suffisamment élevé. Haber se rendit compte qu'il était possible d'extraire une partie des produits, évacués à haute pression du réacteur chimique, et d'injecter de nouvelles quantités de réactifs dans le réacteur pour y maintenir une pression favorisant la production d'ammoniac. Au XXIe siècle, cette technique est aussi appliquée en chimie organique à haute pression[20].
Vitesse de réaction et constante d'équilibre
Pour effectuer la synthèse, il faut considérer deux paramètres contradictoires : la constante d'équilibre et la vitesse de réaction. À la température de la pièce, la réaction est lente et une solution évidente serait d'élever sa température. Cela peut augmenter la vitesse de réaction, mais puisque la réaction est exothermique, ce changement favorise, selon la loi expérimentale de Van't Hoff, la réaction inverse (endothermique). Cela réduit donc la constante d'équilibre qui se calcule par :
Variation de Keq pour l'équilibre de
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
en fonction de la température[34]Température (°C) Keq 300 4,34 x 10–3 400 1,64 x 10–4 450 4,51 x 10–5 500 1,45 x 10–5 550 5,38 x 10–6 600 2,25 x 10–6 Quand la température augmente, l'équilibre se déplace et la constante d'équilibre diminue énormément selon la relation de Van't Hoff. Il faudrait donc imposer une basse température et recourir à d'autres moyens pour augmenter la vitesse de réaction. Cependant, le catalyseur exige une température d'au moins 400 °C pour être efficace.
Sachant que la constante d'équilibre peut être modifiée par la concentration, la température ou la pression, cette dernière est probablement le meilleur paramètre à manipuler pour favoriser la réaction directe. En effet, il y a 4 moles de réactifs pour 2 moles de produits. Selon le principe de Le Chatelier, une augmentation de la pression favorisera la réaction qui diminue la pression du système à l'équilibre.
Une pression d'environ 200 atm modifie suffisamment la constante d'équilibre pour obtenir une production raisonnable. Financièrement, par contre, la production de pression est une opération coûteuse. En effet, les spécifications des tuyaux, des récipients et des valves doivent être plus sévères que les normes habituelles. Le fonctionnement des pompes et des compresseurs à cette pression demande beaucoup d'énergie. Il y a aussi des considérations de sécurité à prendre en compte. Pour toutes ces raisons, un compromis doit être fait : à chaque passage des réactifs, le taux de conversion est d'environ 15 %.
Le taux de conversion de la réaction peut être augmenté en retirant des produits (le gaz d'ammoniac) du système. En pratique, ce gaz n'est pas retiré du réacteur même, puisque la température y est trop élevée, mais du mélange gazeux à l'équilibre qui sort du réacteur. Les gaz chauds sont suffisamment refroidis, même si la pression demeure élevée, pour que l'ammoniac puisse être liquéfié. L'hydrogène et l'azote qui n'ont pas réagi sont à nouveau ré-introduits dans le réacteur dans le but de les convertir en ammoniac.
Catalyseurs
Pour les besoins de cette industrie, le catalyseur à base de fer est préparé en exposant une masse de magnétite, un oxyde de fer, à un gaz de dihydrogène porté à haute température. Cela réduit une partie de la magnétite en fer métallique, éliminant l'oxygène dans le processus. Le volume initial du catalyseur est conservé en grande partie. La masse est devenue un matériau très poreux où sa grande surface de contact multiplie son efficacité catalytique. Le catalyseur inclut également du calcium et des oxydes d'aluminium, ce qui facilite l'activité catalytique et maintient la surface de contact tout au long de son existence, ainsi que du potassium, ce qui augmente la densité électronique du catalyseur et améliore son activité.
En présence du catalyseur, la réaction évoluerait comme suit :
- N2(g) → N2(adsorbé)
- N2(adsorbé) → 2 N(adsorbé)
- H2(g) → H2(adsorbé)
- H2(adsorbé) → 2 H(adsorbé)
- N(adsorbé) + 3H(adsorbé) → NH3(adsorbé)
- NH3(adsorbé) → NH3(g)
La réaction 5 survient en trois étapes, formant successivement NH, NH2 et NH3. Des indices, obtenus à partir de différentes expériences, montrent que la réaction 2 est la plus lente.
La compréhension de ces étapes est en grande partie due aux travaux de Gerhard Ertl[35],[36],[37],[38].
Extraction de l'ammoniac
Production annuelle
Au XXIe siècle, la production d'ammoniac synthétique consomme de 3 à 5% de la production mondiale de gaz naturel[1],[39] (entre 1 et 2% environ de la production mondiale d'énergie[40]).
Production mondiale
d'ammoniac synthétique[note 2]Année Production
(milliers
de tonnes
métriques)Prix moyen
de la tonne
aux États-Unis
(USD)[note 3]1994 92 000[41] 211[41] 1995 96 000[41] 230[41] 1996 96 000[42] 225[42] 1997 96 000[42] 192[42] 1998 106 000[43] 121[43] 1999 101 000[43] 110[43] 2000 109 000[44] 169[44] 2001 105 000[44] 150[44] 2002 109 000[45] 137[45] 2003 108 000[45] 240[45] 2004 117 000[46] 274[46] 2005 115 000[46] 295[46] 2006 124 000[47] 201[47] 2007 125 000[47] 200[47] 2008 136 000[48] 500[48] Pour l'année 2000 ou 2001, Smil affirme que la production annuelle d'ammoniac aurait été d'environ 130 millions de tonnes, dont les 4/5 auraient été transformés en engrais azotés[49]. Pour l'année 2002, Modak affirme que le procédé Haber-Bosch aurait permis la production annuelle de 130 millions de tonnes d'engrais azotés, la plupart sous la forme de sulfate d'ammonium, de phosphate d'ammonium ((NH4)3PO4), de nitrate d'ammonium et d'urée[20]. Selon Lawrence, en 2002, 90 millions de tonnes d'engrais azotés, fabriqués à partir d'ammoniac synthétique, auraient été consommés[11].
Selon Smil, les productions de l'ammoniac et de l'acide sulfurique sont les deux plus importantes par la masse vers la fin des années 1990[50]. Selon Modak, la production de l'ammoniac est la sixième plus importante par la masse en 2002[20].
Conséquences environnementales
Au XXIe siècle, les engrais azotés permettent d'alimenter le tiers de la population mondiale[2],[8].
Cependant, leur utilisation à grande échelle provoque divers effets nocifs pour l'environnement[51]. Selon un rapport de l'ONU publié en 2007, l'application d'engrais serait l'un des facteurs qui provoque « la destruction des habitats de poissons, la pollution côtière et une prolifération néfaste d'algues »[52].
Au début du XXIe siècle, la quantité d'azote fixé de façon synthétique est équivalente à celle fixée par les bactéries nitrifiantes et les éclairs, ce qui a bouleversé le cycle de l'azote. La moitié de l'azote fixé synthétiquement n'est pas absorbé par les plantes, il se retrouve principalement dans l'eau sous forme de nitrates. Par exemple, la concentration de nitrates a quadruplé de 1900 à 2000 dans le fleuve Mississippi aux États-Unis. Dans le Rhin en Allemagne, elle y est deux fois plus élevée. Les impacts de cette concentration élevée sont étudiés, mais il y a peu de certitudes[53].
Les nitrates favorisent la croissance des algues et des herbes aquatiques de surface, lesquelles viennent à recouvrir, en partie ou en totalité, les eaux. Cela mène à une diminution importante de l'ensoleillement des eaux sous-marines. Ce manque de lumière provoque la mort des plantes sous-marines. Leur pourrissement diminue la quantité d'oxygène dissous, laquelle provoque à son tour la mort des êtres vivant dans le fond marin, par exemple les mollusques et les fruits de mer, qui ont besoin de cet oxygène pour vivre[54].
Dans les zones océaniques qui reçoivent les eaux provenant de différents fleuves charriant ces nitrates, le niveau d'oxygène est si bas que leur fond est tapissé de bactéries consommatrices d'oxygène, mortes. C'est le cas par exemple de la mer Baltique, de la Méditérranée, de la mer Noire et de la grande barrière de corail. Au large de la Louisiane en 2008, une telle zone morte s'étendait sur une superficie équivalente à celle du New Jersey, soit environ 22 000 km². Le rôle exact des nitrates est inconnu, mais est important[55].
Le rôle de l'azote dispersé dans l'air est également peu connu en date de 2008. Il se répand sous forme de NO, de NO2 et autres NOx, lesquels participent à la pollution atmosphérique. Une partie de ces NOx proviennent de la combustion de combustible fossile, mais entre 15 et 50 % proviendrait des produits dérivés de l'ammoniac synthétique[56].
En août 2009, une étude publié par le National Oceanic and Atmospheric Administration affirme que le protoxyde d'azote, qui se dégage entre autres des engrais azotés, est la première source de diminution de la couche d'ozone en 2009[57].
Notes et références
Références
- ↑ a et b Smil, 2001
- ↑ a , b et c Hager, 2008
- ↑ (en) Marshall Sittig, Fertilizer Industry: Processes, Pollution Control and Energy Conservation, Noyes Data Corp., New Jersey, 1979 (ISBN 0-8155-0734-8)
- ↑ Smil, 2001, p. xiv
- ↑ a , b et c (en) Carl Bosch - Biography, 1931, Fondation Nobel. Consulté le 3 mars 2009
- ↑ Smil, 2001, p. 83-107
- ↑ a et b Bosch, 1931
- ↑ a et b (en) David W. Wolfe, Tales From the Underground. A Natural History of Subterranean Life, Perseus Pub, Cambridge, Massassuchets, 2001 (ISBN 0738201286) (OCLC 46984480)
- ↑ a et b Bailar, Emeléus, Nyholm et Trotman-Dickenson, 1973, p. 149
- ↑ Hager, 2008, p. 137-140, 142-143
- ↑ a , b , c et d Lawrence, 2006
- ↑ a et b Wisniak, 2002, p. 161.
- ↑ Hager, 2008, p. 25-61
- ↑ Smil, 2001, p.39
- ↑ Smil, 2001, p.61, 71, 73, 74
- ↑ (en) Isis Publication, « Equilibrium (sl) », 2009, Isis Publication. Consulté le 4 avril 2009
- ↑ Haber, 1920, p.337-338
- ↑ BASF avait déposé une demande de brevet en Allemagne en 1908 : voir Brevet DE 235 421 Verfahren zur synthetischen Darstellung von Ammoniak aus den Elementen, demandé le 13 octobre 1908, délivré le 8 juin 1911
- ↑ Bosch, 1931, p. 222
- ↑ a , b , c , d et e (en) Jayant M. Modak, « Haber Process for Ammonia Synthesis », dans Resonance, 2002 [texte intégral (page consultée le 1er mars 2009)]
- ↑ Hager, 2008, p. 167-168
- ↑ (en) Werner Abelshauser, German Industry and Global Enterprise, Cambridge University Press, 2003, 688 p. (ISBN 978-0521827263), p. 187-188
- ↑ Hager, 2008, p. 177-178
- ↑ Hager, 2008, p. 206-207
- ↑ (en) The Claude Process for Ammonia Synthesis, SAO/NASA ADS. Consulté le 7 mars 2009
- ↑ (en) A Brief Profile of Giacomo Fauser, 2001. Consulté le 8 mars 2009
- ↑ (en) « Casale's Most Recent Technologies for Grass-Roots Fertilizer Plants », dans Indian Fertilizer Situation Update, vol. 10, no 01, janvier 2009, p. 3 [texte intégral (page consultée le 7 mars 2009)]
- ↑ Smil, 2001, p. 114
- ↑ Bosch, 1931, p. 240
- ↑ Cette valeur est calculée en se basant sur la dernière section du tableau Estimates of Fertilizer Use by Crop in Selected Countries in 2006-2006/07 (‘000 tonnes nutrients) en page 5 de (en) Patrick Heffer, « Assessment of Fertilizer Use by Crop at the Global Level », 2008, International Fertilizer Industry Association. Consulté le 3 mars 2009.
En 2006-2007, la consommation mondiale d'engrais azotés s'élevait à 97 892 000 tonnes. En divisant ce nombre par 365 jours, on obtient 268 197 tonnes par jour. - ↑ Voir par exemple Considine et Kulik, 2002
- ↑ Haber, 1920, p.338
- ↑ (en) Pawan Agarwal, « Ammonia: The Next Step », dans The Chemical's Engienners Ressource, 7 avril 2001 [texte intégral (page consultée le 21 mars 2009)]
- ↑ (en) Theodore L. Brown, H. Eugene Lemay et Bruce E. Bursten, Chemistry: The Central Science, Ninth Ed., Pearson Publications Company, 2003 (ISBN 0-13-038168-3)
- ↑ (en) F. Bozso, G. Ertl, M. Grunze et M. Weiss, « Interaction of nitrogen with iron surfaces: I. Fe(100) and Fe(111) », dans Journal of Catalysis, vol. 49, no 1, 1977, p. 18–41 [lien DOI]
- ↑ (en) R. Imbihl, R. J. Behm, G. Ertl et W. Moritz, « The structure of atomic nitrogen adsorbed on Fe(100) », dans Surface Science, vol. 123, no 1, 1982, p. 129–140 [lien DOI]
- ↑ (en) G. Ertl, S. B. Lee et M. Weiss, « Kinetics of nitrogen adsorption on Fe(111) », dans Surface Science, vol. 114, no 2-3, 1982, p. 515–526 [lien DOI]
- ↑ (en) G. Ertl, « Primary steps in catalytic synthesis of ammonia », dans Journal of Vacuum Science & Technology, vol. 1, no 2, 1983, p. 1247–1253 [lien DOI]
- ↑ (en) Barry E. Smith, « Structure. Nitrogenase reveals its inner secrets », dans Science, vol. 297, no 5587, septembre 2002, p. 1654–5 [lien DOI]
- ↑ (en) « World fertilizer prices soar as food and fuel economies merge », dans IFDC, 19 février 2008 [texte intégral (page consultée le 3 mars 2009)]
- ↑ a , b , c et d (en) (Nirogen Specialist), « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 1996 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) David E. Morse, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 1998 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, février 2000 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 2002 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 2004 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 2006 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a , b , c et d (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 2008 [texte intégral (page consultée le 22 mars 2009)]
- ↑ a et b (en) Lori E. Apodaca, « Nitrogen (fixed) - Ammonia », dans Mineral Commodity Summaries, U.S. Geological Survey, janvier 2009 [texte intégral (page consultée le 22 mars 2009)]
- ↑ Smil, 2001, p. xv
- ↑ Smil, 2001, p. 127
- ↑ La pollution par les nitrates : une menace invisible qui pèse sur les populations d'amphibiens, 2009, Environnement Canada. Consulté le 2 mars 2009
- ↑ L'avenir de envrionnement mondial 3 - GEO-3, janvier 2007, Programme des Nations unies pour l'environnement. Consulté le 29 March 2009
- ↑ Hager, 2008, p. 272-274
- ↑ Hager, 2008, p. 274
- ↑ Hager, 2008, p. 274-275
- ↑ Hager, 2008, p. 275
- ↑ Lisa Grossman, « Laughing gas is biggest threat to ozone layer », dans New Scientist, 27 août 2009 [texte intégral (page consultée le 28 août 2009)]
Notes
- ↑ Smil, 2001, en page xv, affirme que c'est le 2/5 de la population mondiale, soit environ 2,4 milliards de personnes.
- ↑ Les données proviennent de rapports publiés par l'United States Geological Survey. Pour une année, elles peuvent changer selon la date de publication du document. Par exemple, le rapport publié en février 2000 ([1]) indique que la production mondiale de 1999 était de 101 000 000 tonnes métriques, alors que le rapport publié en janvier 2001 ([2]) donne 108 000 000.
- ↑ Ce prix est calculé avec franco à bord à partir de la côte du golfe américaine.
Traductions de
Voir aussi
Articles connexes
Liens externes
- Sur le procédé
- (en) Michael Anissimov, « What is the Haber-Bosch Process? », 2003-2009, Conjecture Corporation. Consulté le 1er mars 2009
- (en) Jürgen Schmidhuber, « HABER & BOSCH - Haber-Bosch process », 2003-2009. Consulté le 1er mars 2009
- (en) Haber Process: Ammonia Production, AUS-e-TUTE. Consulté le 1er mars 2009
- (en) Jim Clark, « The Haber Process », 2002, Chemguide
- Sur la production industrielle
- (de) Plonsker Media Gmbh, « Die Ammoniaksynthese », 2006, Plonsker Media Gmbh (site dédié à la synthèse de l'ammoniac)
- (en) R. Callaghan, « Nitrogen - Statistics and Information », 2009, United States Geological Survey (résumés sur deux pages de l'état des productions américaine et mondiale de l'ammoniac synthétique, de 1996 à 2009)
Bibliographie
- (en)J. C. Bailar, H. J. Emeléus, Sir Ronald Nyholm et A.F. Trotman-Dickenson et K. Jones, Nitrogen, Comprehensive Inorganic Chemistry, Pergamon Press, New York, 1973, 547 p. (ISBN 0-08-017275-X), p. 149-150
- (en) Vaclav Smil, Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production, The MIT Press, 2001, 358 p. (ISBN 978-0-262-69313-4)
- (en) Thomas Hager, The Alchemy of Air: A Jewish Genius, a Doomed Tycoon, and the Scientific Discovery That Fed the World but Fueled the Rise of Hitler, Harmony Books, New York, 2008, 336 p. (ISBN 978-0-307-35178-4)
- (en) Fritz Haber, The Synthesis of Ammonia From its Elements, Fondation Nobel, Oslo, Suède, 1920, 15 p.
- (en) Carl Bosch, The Development of the Chemical High Pressure Method During the Establishment of the New Ammonia Industry, Fondation Nobel, Oslo, Suède, 1931, 45 p.
- (en)Glenn D. Considine et Peter H. Kulik et , Ammonia, Van Nostrand's Scientific Encyclopedia, Ninth Editin, John Wiley & Sons, inc., Canada, 2002 (ISBN 0-471-33230-5), p. 140-143
- (en) Stephen A. Lawrence, Amines. Synthesis, Properties and Applications, Cambridge University Press, 2006, 384 p. (ISBN 978-0521029728), « An introduction to the amines »
- [pdf] (en) Jaime Wisniak, « Fritz Haber - a Conflicting Chemist », dans [Journal of History of Science], vol. 37, no 2, 26 décembre 2002, p. 153-173 (ISSN 0019-5235) [texte intégral (page consultée le 24 juillet 2009)]
- Portail de la chimie
Catégories : Procédé chimique | Catalyse
Wikimedia Foundation. 2010.