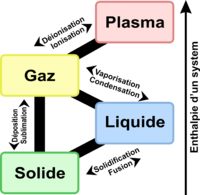
- Température de fusion moléculaire
-
Température de fusion
La température de fusion ou point de fusion d'un corps représente la température à laquelle un élément pur ou un composé chimique passe de l'état solide à l'état liquide. Le point de congélation est la transition inverse. Elle est habituellement mesurée sous pression atmosphérique normale (1 atmosphère) et il y coexistence entre état solide et état liquide entre ces deux points. Pour une substance pure, les points de fusion et de congélation sont théoriquement égaux et constants à pression fixe. Le point de fusion/congélation le plus connu est probablement celui de l'eau (0 °C), celui-ci ayant étant pris comme zéro de l'échelle centigrade, souvent confondue avec l'échelle Celsius[1].
Il est possible de déterminer la nature d'une substance (identification) par la mesure de la température de fusion. Toutefois, cette information n'est pas suffisante pour permettre une identification formelle, plusieurs molécules pouvant avoir une température de fusion très proche. Elle permet par contre d'éliminer du champ du possible des molécules ayant une température de fusion différente de celle mesurée.
Sommaire
Théorie
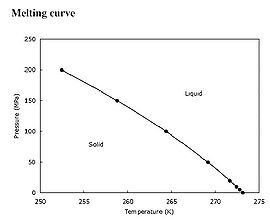 Graphique de la dépendance de la pression sur la température de fusion de l'eau (MPa/K)
Graphique de la dépendance de la pression sur la température de fusion de l'eau (MPa/K)
La plupart des substances se liquéfient et se solidifient approximativement à la même température. Par exemple, pour le mercure le point de fusion et de congélation sont 234,32 K ( -38,83 °C). Cependant, plusieurs substances ont la caractéristique de pouvoir être en surfusion et peuvent donc geler à une température inférieur à leur point de congélation théorique. L'eau en est un exemple car la pression de surface des molécules d'eau pure est difficile à vaincre et on peut retrouver des gouttelettes d'eau jusqu'à -42 °C dans les nuages si elles ne contiennent pas un noyau de congélation[1].
Thermodynamique
Lorsqu'un corps solide pur est chauffé, la température augmente jusqu'à atteindre le point de fusion. Là, la température reste constante tant que le corps n'est pas passée entièrement sous phase liquide. La différence d'énergie pour causer la fusion complète n'est donc pas seulement celle qu'on doit ajouter pour atteindre la température critique mais également la chaleur latente (Lf) pour passer à l'état liquide. Du point de vue de la thermodynamique, l’enthalpie (H) et l’entropie (S) du matériau augmentent donc (ΔH,ΔS > 0) à T la température de fusion de telle façon qu’on peut les exprimer lors du changement d’un corps de masse m ainsi :
- ΔH = mLf et
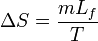 ce qui donne
ce qui donne 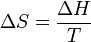
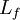 Chaleur latente massique exprimée en J/kg
Chaleur latente massique exprimée en J/kg- ΔH Variation d'enthalpie en J
- ΔS Variation d'entropie en J/K
- m masse en kg
- T Température en K
Caractéristiques
Contrairement à la température de vaporisation (point d'ébullition), la température de fusion est assez insensible aux changements de pression, car les volumes molaires de la phase solide et de la phase liquide sont assez proches[2],[3].
Généralement, lorsque l'on reste dans la même famille de composés chimiques, le point de fusion augmente avec la masse molaire. L'élément de la table période ayant la plus haute température de fusion est le tungstène à 3 683 K (3 410 °C) ce qui en a fait un excellent choix pour les lampes à incandescence. Le Ta4HfC5 est le réfractaire qui a le point de fusion le plus élevé à 4 488 K (4 215 °C)[réf. nécessaire]. À l'autre bout du spectre, l’hélium ne se congèle qu'à une température près du zéro absolu et avec une pression de 20 atmosphères.
Le point de fusion est donc un moyen de vérifier la pureté d'une substance : toute impureté fera varier le point de fusion de la substance testée.
Cas particuliers
La transition entre solide et liquide se produit cependant sur une certaine plage de température pour certaines substances. Par exemple, l’agar-agar fond à 85 °C mais se solidifie entre 31 °C et 40 °C par une processus d’hystérésis. D'autre part, les substances amorphes, comme le verre, n'ont en général pas de point de fusion, car elles ne subissent pas de fusion proprement dite mais une transition vitreuse.
Il existe également d’autres exceptions :
- Deux formes polymorphes ont souvent deux points de fusion différents ;
- Pour les molécules, on parle de température de fusion moléculaire[réf. nécessaire].
- Certaines substances n'ont pas de point de fusion observable. Ceci peut être dû à plusieurs phénomènes :
- la sublimation, c'est-à-dire le passage direct à l'état gazeux (par exemple l’iode ou le carbone) ;
- une décomposition à l'état solide (exemple des sels de diazonium) ;
- les polymères réticulés n'ont pas de point de fusion car la réticulation empêche tout glissement des chaînes les unes par rapport aux autres. Formellement, le "bloc de polymères" n'est qu'une seule et unique molécule.
Appareils de mesure
Il existe différents appareils de mesure de point de fusion reposant tous sur la restitution d'un gradient de température. Ils peuvent être constitués soit d'une plaque métallique chauffante tel le banc Köffler, soit d'un bain d'huile tel le tube de Thiele.
Température de fusion des corps purs sous pression atmosphérique
Z Corps pur Formule
chimiqueTf (°C) Tf (K) Période 1 1 dihydrogène H2 -259,1 ℃ 14,025 K 2 hélium He —[4] — Z Corps pur Formule
chimiqueTf (°C) Tf (K) Période 2 3 lithium Li 180,5 ℃ 453,69 K 4 béryllium Be 1 278 ℃ 1 551,15 K 5 bore B 2 075,9 ℃ 2 349 K 6 graphite C 3 499,9 ℃ 3 773 K 7 diazote N2 -210 ℃ 63,14 K 8 dioxygène O2 -222,8 ℃ 50,35 K 9 difluor F2 -219,6 ℃ 53,53 K 10 néon Ne -248,6 ℃ 24,56 K Z Corps pur Formule
chimiqueTf (°C) Tf (K) Période 3 11 sodium Na 97,7 ℃ 370,87 K 12 magnésium Mg 649,9 ℃ 923 K 13 aluminium Al 660,3 ℃ 933,47 K 14 silicium Si 1 413,9 ℃ 1687 K 15 phosphore P 44,2 ℃ 317,3 K 16 soufre S 115,2 ℃ 388,36 K 17 dichlore Cl2 -101,5 ℃ 171,6 K 18 argon Ar -189,3 ℃ 83,8 K Z Corps pur Formule
chimiqueTf (°C) Tf (K) Période 4 19 potassium K 63,4 ℃ 336,53 K 20 calcium Ca 841,9 ℃ 1115 K 21 scandium Sc 1 540,9 ℃ 1814 K 22 titane Ti 1 667,9 ℃ 1941 K 23 vanadium V 1 901,9 ℃ 2175 K 24 chrome Cr 1 856,9 ℃ 2130 K 25 manganèse Mn 1 243,9 ℃ 1517 K 26 fer Fe 1 534,9 ℃ 1808 K 27 cobalt Co 1 494,9 ℃ 1768 K 28 nickel Ni 1 454,9 ℃ 1728 K 29 cuivre Cu 1 084,4 ℃ 1357,6 K 30 zinc Zn 419,5 ℃ 692,68 K 31 gallium Ga 29,8 ℃ 302,91 K 32 germanium Ge 938,3 ℃ 1211,4 K 33 arsenic As 816,9 ℃ 1 090 K 34 sélénium Se 220,9 ℃ 494 K 35 dibrome Br2 -7,3 ℃ 265,8 K 36 krypton Kr -157,4 ℃ 115,79 K Température de fusion des polymères ou corps plastiques
Entre 125 °C et 325 °C pour les divers polymères ou corps plastiques, d'après S.A. plastiques Obra.
Type Sigles Point de fusion Température d'utilisation Exemples Acrylonitrile butadiène styrène ABS 130 °C 60 °C / -35 °C Polyacétal copolymère ou Polyoxyméthylène POMC ou POM 165 °C 100 °C / -40 °C Ertacetal Polyamide 6,6 PA6-6 255 °C 120 °C / -30 °C Polyamide 6 PA6 220 °C 100 °C / -40 °C Nylon, Akulon, Ertalon Polycarbonate PC 230 °C 135 °C / -60 °C Makrolon, Lexan, Arla, Resart Polyester thermo plastique ou Polyéthylène téréphtalate PETP ou PET 255 °C 100 °C / -20 °C Arnite, Ertalyte Polyester thermo plastique transparent PETG 255 °C 150 °C / -20 °C Griphen, Vivak, Vectan Polyétheréthercétone PEEK 220 °C (250 °C)? / -60 °C Polyéthylène basse densité PEBD ??? 70 °C / ??? Polyéthylène haute densité 300 PEHD 300 °C 130 °C 80 °C / -100 °C Polyéthylène très haute densité 500 PEHD 500 135 °C 80 °C / -100 °C Polyéthylène très haute densité 1000 PEHD 1000 138 °C 80 °C / -260 °C Polyméthacrylate de méthyle coulé PMMA plexi gs 180 °C 70 °C / -40 °C Plexiglass, Polivar, Perspex Polyméthacrylate de méthyle extrudé PMMA plexi XT 168 °C 70 °C / -40 °C Perspex, Acrilex Polypropylène PP 163 °C 100 °C / -10 °C Polystyrène PS 160 °C 60 °C / -10 °C Polytétrafluore ou Polytétrafluoroéthylène PTFE 325 °C 260 °C / -200 °C Téflon Polyvinylchlorure surchlore ou Polychlorure de vinyle surchloré PVC C ou CPVC 190 °C 100 °C / -10 °C Polyvinylchlorure ou Polychlorure de vinyle PVC 125 °C 60 °C / -10 °C Polyvinylchlorure cellulaire ou expansé PVC cellulaire ??? ??? / ??? Forex, Kömacel Polyvinylidene fluoride ou Polyfluorure de vinylidène PVDF 173 °C 140 °C / -40 °C Tissu bakelisé HGW ??? ??? / ??? Notes et références
- ↑ a et b R. Feistel and W. Wagner, « A New Equation of State for H2O Ice Ih », dans J. Phys. Chem. Ref. Data, vol. 35, 2006, p. 1021–1047 [lien DOI]
La température de congélation/fusion de l'eau est 0,002519 +/- 0.000002 °C
- ↑ La relation exacte est exprimée dans la formule de Clapeyron
- ↑ (en)J10 Heat: Change of aggregate state of substances through change of heat content: Change of aggregate state of substances and the equation of Clapeyron-Clausius. Consulté le 2008-02-19
- ↑ n'existe pas à l'état solide sous 1 atm
- Portail de la chimie
- Portail de la physique
Catégorie : Propriété chimique - ΔH = mLf et
Wikimedia Foundation. 2010.