- Éthanal
-
Éthanal 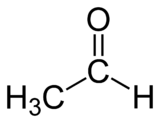
Formule semi-développée de l'éthanal Général Nom IUPAC éthanal Synonymes acétaldéhyde
aldéhyde acétique
aldéhyde éthyliqueNo CAS No EINECS FEMA SMILES InChI Apparence gaz ou liquide incolore, d'odeur âcre[1]. Propriétés chimiques Formule brute C2H4O [Isomères] Masse molaire[3] 44,0526 ± 0,0022 g·mol-1
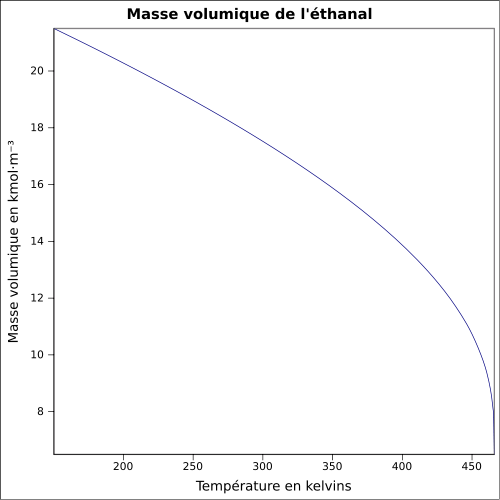
C 54,53 %, H 9,15 %, O 36,32 %,Moment dipolaire 2,750 ± 0,006 D [2] Propriétés physiques T° fusion -123,37 °C [4] T° ébullition 20,1 °C [4] Solubilité dans l'eau : miscible[1] Masse volumique 0,7834 g·cm-3 à 18 °C [4] T° d'auto-inflammation 185 °C[1] Point d’éclair -38 °C (coupelle fermée)[1],
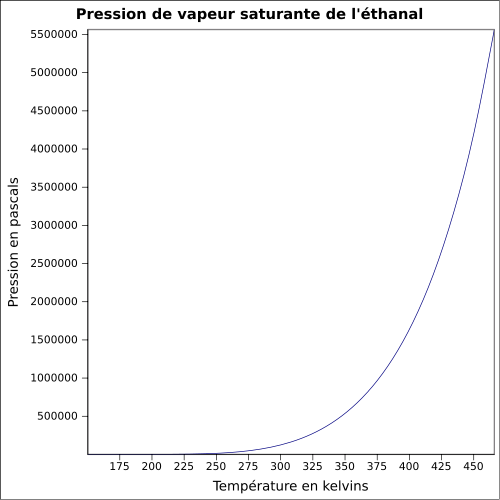
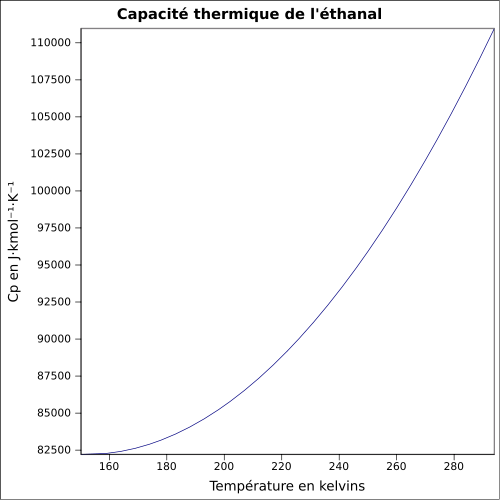
-50 °C (coupelle ouverte)[6]Limites d’explosivité dans l’air en % volume dans l'air : 4 - 60[1] Pression de vapeur saturante à 20 °C : 101 kPa[1] Viscosité dynamique ~0,215 à 20 °C Point critique 192,85 °C, 5,55 MPa, 0,154 l·mol-1[7] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 10,229 ± 0,0007 eV (gaz)[9] Propriétés optiques Indice de réfraction  1,3316 [10]
1,3316 [10]Précautions Directive 67/548/EEC 
Xn
F+Phrases R : 12, 36/37, 40, Phrases S : 2, 16, 33, 36/37, [11] Transport 33 1089 NFPA 704 SIMDUT[13] 

SGH[14] 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[12] Écotoxicologie LogP 0,63[1] Seuil de l’odorat bas : 0,0028 ppm
haut : 1 000 ppm[15]Unités du SI & CNTP, sauf indication contraire. L'éthanal (Nomenclature IUPAC), aussi appelé acétaldéhyde, aldéhyde acétique, éthyl aldéhyde ou oxoéthane, est un composé chimique, un aldéhyde de formule chimique CH3CHO.
Naturellement produit par les plantes, c'est un composant volatil trouvé à faibles doses dans les fleurs et feuilles du coton, dans les feuilles de chêne et de tabac, dans les fruits mûrs, le café, et le pain frais. Il contribue à l’odeur du romarin, des jonquilles, de l’orange amère, du camphre, du fenouil, de la moutarde et de la menthe. Il servait autrefois de matière première de base pour la synthèse de l’acide acétique et de l’anhydride acétique. Il est utilisé comme agent de sapidité dans certaines margarines. C'est un produit toxique et cancérigène suspecté[6]
Sommaire
Propriétés chimiques
L'éthanal est un liquide incolore, volatil et miscible à l'eau et à presque tous les solvants organiques.
Notre odorat le perçoit à très faible dose (0,05 ppm suffisent) comme une odeur fruitée (pomme verte) et il devient suffocant et piquant à forte teneurs.
Il est très réactif et inflammable (point d'ébullition: 20,2 °C). Il peut vivement réagir avec par exemple des oxydants, halogène, ammoniac, aminés, alcools, cétones, phénols, anhydrides d'acides, sulfure d'hydrogène, cyanures. En contact avec le cuivre ou des alliages en contenant (bronze..), il peut former des composés explosifs. Il ronge le caoutchouc.
Comme tous les aldéhydes, c'est un réducteur. Son oxydation, très facile puisqu'elle peut même se produire au contact de l'air, donne l'acide acétique, de l'anhydride acétique et de l'acide peroxyacétique instable susceptible de spontanément exploser ..
L'hydrogénation de l'éthanal donne de l'éthanol.
Trois molécules d'acétaldéhyde peuvent former un paraldéhyde cyclique. Quatre molécules d'acétaldéhyde peuvent former un tétramère d'acétaldéhyde cyclique. Son numéro UN est UN 1089.
Production et synthèse
Il est obtenu par oxydation catalytique directe de l’éthylène. 2 CH2 = CH2 + O2 → 2 CH3CHO
Un autre procédé consiste en une hydratation en présence de HgSO4, à partir de l'acétylène: C2H2 + H2O → CH3CHO
Liens avec l'alcool
Dans le foie
Article détaillé : Alcoolémie#Élimination.Dans les hépatocytes du foie, l'enzyme alcool déshydrogénase (ADH, EC 1.1.1.1) convertit l'éthanol en éthanal qui est ensuite converti en acide acétique inoffensif par l'acétaldéhyde déshydrogénase (EC 1.2.1.10). L'éthanal est plus toxique que l'éthanol et pourrait être responsable de nombreux symptômes de la gueule de bois, même s'il n'est pas présent dans le sang pendant les symptômes[16]. Certains auteurs estiment qu'il est responsable du syndrome de l'alcoolisme fœtal[17]
Une partie de la population humaine (en particulier des groupes présents en Asie et Extrême-Orient) ne disposent pas de gènes codant l'enzyme capable de dégrader l'acétaldéhyde en acide acétique, ce qui provoque chez elles des symptômes graves et immédiats et aggrave les effets délétères de l'alcool qu'elles boiraient.
Lors de la fermentation alcoolique
Les dernières étapes de la fermentation alcoolique des bactéries, plantes et levures impliquent la conversion du pyruvate en acétaldéhyde par l'enzyme pyruvate décarboxylase (EC 4.1.1.1), suivie de la conversion de l'acétaldéhyde en éthanol. La dernière réaction est de nouveau catalysée par la déshydrogénase d'alcool, fonctionnant dans la direction opposée. L’éthanal semble jouer un rôle important dans l’évolution de la couleur des vins rouges au cours de leur conservation.
Toxicité, cancérogénicité
L'acétaldéhyde est un cancérigène animal établi.
- Il conduit, par inhalation, à l'apparition de tumeurs de la trachée chez le hamster[18],[19],[20],[21].
- Son inhalation accroit chez les rats des deux sexes l'incidence des carcinomes spinocellulaires qui affectent de nombreuses muqueuses à épithélium malpighien et des carcinomes et adénocarcinomes de la muqueuse nasale
C'est un cancérigène humain présumé en raison des effets mutagènes, embryotoxiques et tératogènes démontré chez l'animal.
La fumée de cigarette en contient d'importantes quantités (de l'ordre du milligramme par cigarette).
On pense qu'il explique le fait que tous les alcools (bière, vin, alcools forts) soient des facteurs de risque accru de cancer en particulier de cancer du sein chez la femme (via la dégradation de l'alcool en acétaldéhyde par l'organisme).Impact sur l'environnement
Atmosphère
L’acétaldéhyde ne contribue pas à la destruction de la couche d'ozone stratosphérique et n’est pas non plus un facteur important du changement climatique. À cause de sa photoréactivité et des concentrations modérées présentes dans l’air urbain, il joue un rôle dans la synthèse photochimique d’ozone troposphérique. L'acétaldéhyde peut aussi participer à des processus mineurs dont la photolyse directe, la réaction avec les radicaux nitrate (NO3) et hydropéroxyle (HO2) et la réaction avec l’ozone (O3).
Des valeurs limites (indicatives) pour l'air ont été établies dans certains pays, par exemple 100 ppm (ou 180 mg·m-3 (VME) en France, 25 ppm aux USA (ACGIH) et 50 ppm, soit 91 mg·m-3 en Allemagne.
Eau
Seules de très petites quantités se retrouvent dans l’eau. Lorsque l’acétaldéhyde est rejeté dans l’eau, il s'y dégrade complètement et ne pollue pas d’autres milieux. Dans l’eau, l’acétaldéhyde peut réagir avec les radicaux hydroxyle.
Voir aussi
- Liste des substances d'intérêt prioritaire, rapport d'évaluation, Acétaldéhyde, du ministère des Travaux publics et des Services gouvernementaux Canada de mai 2000, ISBN 0-662-84418-1.
Références
- ACETALDEHYDE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) W. M Haynes, CRC Handbook of chemistry and physics, Boca Raton, CRC Press/Taylor and Francis, 2011, 91e éd., 2610 p. (ISBN 978-143982-077-3), p. 3-4
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Fiche toxicologique N° 120 de l'INRS, consultée le 8 août 2009
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », dans Chinese Journal of Chemical Engineering, vol. 17, no 2, avril 2009, p. 259-267 [lien DOI (page consultée le 25 janvier 2010)]
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0071432205), p. 2.289
- « acétaldéhyde » sur ESIS, consulté le 15 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Acétaldéhyde » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Acetaldehyde sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Robert Swift, M.D., Ph.D.; and Dena Davidson, Ph.D., « Science: Aches, pains and dehydration: the science of a hangover », NIAAA, 1998. Consulté le 05/02/2008
- Blakley PM, Scott WJ Jr - Determination ot the proximate teratogen of the mouse fetal alcohol syndrome. 2 Phamacokinetics of the placental transfer of ethanol and acetaldehyde. Toxicology and Applied Pharmacology, 1984. 72, pp 364-371
- Garnier R, Chataignier D, Efthymiou ML, Aldéhydes, In : Encyclopédie médico-chirurgicale, Intoxications, pathologie du travail, 16048 A 50, 9-1990, 13 p
- Woutersen R.A et al. Inhalation toxicity of acetaldehyde in rats II. Carcinogenicity study : interim results after 15 months, Toxicologgy, 1984, 31, pp 123-133
- Woutersen R.A et al. Inhalation toxicity of acetaldehyde in rats III. Carcinogenicity study. Toxicologgy, 1986, 41, pp 213-231
- Feron VJ, Kruysse A, Woutersen RA, Respiratory tract tumours in hamsters exposed to acetaldehyde vapour alone or simultaneously to benzol[a]pyrene or diethylnitrosamine. European Jouranl of Cancer and Clinical Oncology, 1982, 18, pages 13 à 31
Liens externes
- (fr) Fiche internationale de sécurité
- (fr) Fiche américaine de sécurité (NIEHS)
- (en) Hal Kibbey: Genetic Influences on Alcohol Drinking and Alcoholism, Indiana University Research and Creative Activity, Vol. 17 no. 3.
- (en) United States Food and Drug Administration (FDA) information for acetaldehyde
Catégories :- Produit chimique nocif
- Produit chimique extrêmement inflammable
- Cancérogène chimique
- Aldéhyde
- Cancérogène du groupe 2B du CIRC
Wikimedia Foundation. 2010.