- Acide (chimie)
-
Acide
 Pour les articles homonymes, voir Acide (homonymie).
Pour les articles homonymes, voir Acide (homonymie).Un acide est un composé chimique généralement défini par ses réactions avec un autre type de composé chimique complémentaire, les bases.
Sommaire
Définitions
L’acidité fut d’abord définie par Svante August Arrhenius à la fin du XIXe siècle : un acide est un composé chimique pouvant libérer des protons (ions H+) en solution aqueuse et une base un composé chimique pouvant libérer des ions hydroxydes (OH-) en solution aqueuse. Mais cette définition n’était pas assez générale et n’expliquait pas la basicité de certains composés chimiques ne libérant pas de OH- en solution aqueuse.
Acide de Bronsted
Selon la théorie de Bronsted-Lowry (1923) un acide est toute espèce qui libère un ou plusieurs protons, et une base toute espèce qui capte un ou plusieurs protons. Les protons ne peuvent exister à l'état libre en solution, la théorie de Bronsted met donc l'accent sur le couple acide/base:
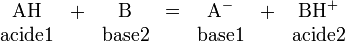
Les réactions qui vont avoir lieu entre un acide et une base sont nommées : réactions acido-basique, ou réactions acide-base. Un tel acide est appelé acide de Bronsted.
Dans cette théorie, l'autoprotolyse de l'eau s'interprète comme la réaction de l'acide eau sur la base eau. L'eau est donc un ampholyte.
L'avantage de cette théorie sur la théorie d'Arrhénius est double:
- La théorie justifie que certaines espèces comme l'ammoniac soit basiques
- La théorie ne donne pas de poids particulier au solvant, on peut donc parler de réaction acido-basique, même en phase gazeuse
Acide de Lewis
Article détaillé : acide de Lewis.La définition de Lewis (1923) est de loin la plus large : un acide de Lewis est accepteur de doublets, ayant donc une orbitale vide, et une base de Lewis est un donneur de doublets, ayant un doublet libre. Par cette définition, un acide est un composé chimique qui peut, au cours d’une réaction, accepter une paire d’électrons (un doublet). C’est donc un composé chimique électrophile, qui possède une lacune électronique dans sa structure.
On peut aisément reconnaître un acide grâce à des tests de pH. Une solution acide a un pH inférieur à 7, à 25 °C. Plus le pH est bas, plus l’acidité est forte. Pour mesurer le pH, on peut effectuer différents tests : papiers pH, indicateurs colorés, utilisation d’un pH-mètre, feuilles de choux rouge, etc.
Les espèces acides au sens de Bronsted peuvent libérer un ou plusieurs protons on parle alors respectivement de monoacides et de polyacides
Acide dans l’eau
Pour les réactions dans l’eau, on utilise habituellement la définition de Bronsted. Un acide peut être représenté par la formule générique AH.
On établit une distinction entre les acides faibles et les acides forts. Ces derniers sont caractérisés par le fait que lorsqu’ils sont placés dans l’eau, l’entité AH n’existe plus en solution car la réaction de dissociation est totale.
Parmi les acides forts, on retrouve les hydracides (tels les acides halohydriques HCl, HBr, HI) et les oxacides (molécules acides possédant un atome central avec un haut degré d’oxydation entouré d’atomes d’oxygène, par exemple : acide nitrique, acide sulfurique, acide perchlorique, acide permanganique).
On classe les acides faibles (acide formique, acide acétique « vinaigre ») en fonction de leur constante d’acidité.
Dans l’eau, l’acidité est mesurée à l’aide de l’échelle des pH. L’eau est à la fois un acide faible et une base faible (c’est un amphotère ou ampholyte).
On ne parle plus d’acide/base « Fort(e)s » mais d’acide ou base « totalement dissociée ».
On compare habituellement la force des acides avec l'eau selon la réaction générale suivante:
AH + H2O = A- + H3O+
Plus la réaction est déplacée vers la droite plus l'acide est fort. Certaines classes d'acide comme l'acide chlorhydrique décalent la réaction complètement vers la droite. Il n'est alors plus possible de les comparer car ils donnent tous le même résultat.
Ce phénomène est du au solvant et on parle d'effet nivelant de l'eau. Pour comparer les forces des acides/bases totalement dissociés, on utilisera un autre solvant (exemple : éthanol…) moins réactif, c'est-à-dire moins basique.
Dans l’eau, l’acide le plus fort est H3O+ (H(aqueux)+ solvant) et la base la plus forte est HO-. Il convient de garder en mémoire que ces notations (H3O+ et HO-) ne constituent qu’une simplification schématique du système. Dans la réalité, H+ et HO- sont tous deux entourés par une sphère de solvatation (plusieurs molécules d’eau, polaires, établissant des liaisons de type électrostatique avec les ions). Une notation plus rigoureuse devrait donc être H(H2O)n+ et HO(H2O)n-. Cependant, cette notation plus rigoureuse n’apporte rien à la compréhension des phénomènes acido-basiques.
Acides dans d’autres solvants
La généralisation de la notion d’acidité a permis d’étendre l’étude à d’autres solvants.
Solvants protiques
Ce sont des solvants capables de céder et capter un atome d’hydrogène. Par exemple NH3 (donne NH2- et NH4+), HF, CH3COOH, H2SO4, etc. Dans ces solvants, la notion de couple acide-base reste centrée sur l’échange de protons et les couples dans ces solvants restent les mêmes que dans l’eau. L’intérêt de ce type de solution vient de la réaction d’autoprotolyse du solvant qui limite la force des acides (et des bases) pouvant exister en solution. On utilisera donc un solvant plus basique que l’eau comme NH3 pour travailler avec des bases très fortes comme H-CC:- et un solvant plus acide comme H2SO4 pour travailler avec des acides forts.
Solvants non protiques
Le transfert particule peut se faire avec autre chose qu’un proton. Dans un solvant comme NO2, on a la réaction 2 NO2 → NO3- + NO+ qui peut être vue comme le transfert d’un ion O2- c’est la définition des acides de Lux-Flood. On peut alors définir une base comme un donneur d’ion O2-(riche en électron) et un acide comme un accepteur d’ion O2-. Dans d’autres cas c’est un transfert d’ion F-. Ce type de conception des réaction en solution joue un rôle important en métallurgie et dans l’étude des roches (voir ci-dessous).
Acides en géologie
En géologie, on dit qu’une pierre est acide si elle renferme plus de 65 % de silice. Ceci est une règle qui traduit la définition des acides de Lux-Flood : la silice qui est un accepteur d’ion oxyde O2- est acide.
- SiO2 + H2O = H2SiO3
Donc les roches riches en silice sont acides, les roches riches en calcaire sont basiques. Cela a une importance pour comprendre le comportement des magmas (notamment dans les volcans), et lorsque l’on veut dissoudre une roche pour l’analyser, par exemple dissolution dans un acide pour analyse par ICP ou bien dissolution dans un verre pour analyse par spectrométrie de fluorescence X (technique dite de la « perle fondue »).
Pour cette dernière application, on estime souvent l’acidité par l’indice d’acidité, qui est le nombre d’atomes d’oxygène divisé par le nombre d’autres atomes ; par exemple, le SiO2 a un indice d’acidité de 2, le CaCO3 a un indice d’acidité de 1,5.
Goût
Le goût acide est reconnu grâce à des récepteurs particuliers PKD2L1, qui sont probablement sensibles à la présence des ions H+, ou à certains nucléotides cycliques. Malgré certaines études on sait à présent que sa reconnaissance est indépendante de la reconnaissance du goût salé. Ces récepteurs jouent aussi un rôle physiologique important dans le reste de l’organisme et sont exprimés à la surface de certaines cellules pour contrôler la quantité de CO2 dans le sang ou la quantité de liquide cérébrospinal.
Dissolution acide
Une des principales propriétés des solutions acides est de pouvoir dissoudre un grand nombre de matériaux. Le pouvoir de dissolution dépend de la concentration de l’acide et de la nature chimique du matériau et de l’acide.
Les métaux, quand le potentiel redox du couple cation / métal dérivant de ce métal est inférieur à 0, ne sont pas stables dans les solutions acides, ils sont donc oxydés (c’est-à-dire ionisés par perte d’un ou plusieurs électrons) ; l’ion métallique peut alors rester sous forme dissoute (solvatée), ou se combiner avec un ou plusieurs ions oxygène et former un oxyde. L’acidité est un des paramètres importants de la corrosion aqueuse. La dissolution des métaux est utilisée en gravure d’art, c’est la technique de l’eau-forte ; elle est aussi utilisée en métallographie pour révéler des défauts (par exemple joints de grain).
Le calcaire se dissout aisément avec des acides faibles ; on nettoie les robinetteries avec du jus de citron (acide citrique) ou du vinaigre (acide acétique).
Les verres peuvent être dissous par de l’acide fluorhydrique, mais la manipulation de cet acide est extrêmement dangereuse, du fait de la présence d’ions fluorures.
Les acides concentrés peuvent provoquer des brûlures sur la peau et les muqueuses (yeux, nez, bouche). En cas de brûlure par acide, il faut :
- protéger : en se protégeant (gants…), fermer le récipient et éviter que l’acide ne se répande (utilisation de papier absorbant), ouvrir les fenêtres pour éviter les dégagements de vapeurs ;
- retirer les vêtements imbibés (en faisant attention à ne pas contaminer d’autres personnes ou des parties saines de la victime) ;
- faire ruisseler de l’eau pour laver la partie atteinte, en évitant de contaminer les parties saines ;
- prévenir les secours (« 112 » dans l’Union européenne, « 15 » en France) en mentionnant le produit en cause.
L’utilisation d’acides concentrés doit toujours se faire par des personnes formées et équipées (blouse, gants, lunette), sous hotte.
Principaux acides
Voici quelques-uns des principaux acides :
- l'acide acétique, de formule (CH3COOH), acide principal du vinaigre ;
- l'acide acétylsalicylique, de formule (HC9H7O4), plus connu sous le nom d'aspirine ;
- l'acide ascorbique, de formule (H2C6H6O6), plus connu sous le nom de vitamine C ;
- l'acide citrique, de formule (H3C6H5O7), un acide présent dans les agrumes ;
- l'acide chlorhydrique, de formule (HCl, en solution aqueuse : H3O++ Cl-(aq)), couramment utilisé dans l'industrie.
Bibliographie
- F. Claisse, Physics and chemistry of borate fusion
Articles connexes
- Portail de la chimie
Catégories : Chimie générale | Acide
Wikimedia Foundation. 2010.

