- 1313-13-9
-
Dioxyde de manganèse
Dioxyde de manganèse 
Général Nom IUPAC Dioxyde de manganèse No CAS No EINECS Apparence poudre noire à brune.[1] Propriétés chimiques Formule brute MnO2 [Isomères] Masse molaire 86,9368 g∙mol-1
Mn 63,19 %, O 36,81 %,Propriétés physiques T° fusion (décomposition) : 553 °C[1] Solubilité dans l'eau : nulle[1] Masse volumique 5.0 g/cm³[1] Thermochimie S0solide 53,1 J/mol·K ΔfH0solide -520,9 kJ/mol Précautions Directive 67/548/EEC 
XnPhrases R : 20/22, Phrases S : (2), 25, Transport 55 1479 NFPA 704 SIMDUT[2] 

SGH[3] 
AttentionUnités du SI & CNTP, sauf indication contraire. L’oxyde de manganèse (IV) MnO2 est un composé chimique aussi connu comme dioxyde de manganèse. Il est de couleur noire ou brun. On le trouve naturellement dans la pyrolusite, qui est la principale source de manganèse métallique. Il est également présent dans les nodules de manganèse.
Sommaire
Formule
Le dioxyde de manganèse de formule MnO2 est obtenue par oxydation du manganèse de formule Mn. L'équation bilan de cette réaction est simple :
- Bilan: manganèse + dioxygène
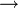 dioxyde de manganèse
dioxyde de manganèse - Équation bilan :Mn + O2
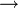 MnO2
MnO2 - Équation bilan équilibré :Mn + O2
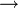 MnO2
MnO2
Autres oxydes
Une substance grise, le manganate de potassium, est obtenue après une fusion de 10 minutes de l’oxyde de manganèse avec un sel alcalin et ajoutant des agents oxydants comme le salpêtre (nitrate de potassium, KNO3) ou du perchlorate de potassium (KClO4). Le manganate de potassium peut être purifié par distillation sous vide pour donner des cristaux vert foncé (prismes orthorhombiques). Le manganate de potassium n’est soluble que dans les alcalis ; dans les conditions non-alcalines, il se dismute en permanganate de potassium et en oxyde de manganèse(IV) (MnO2), selon l'équation :
- 3 MnO42- + 4 H+
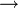 2 MnO4- + MnO2(s) + 2 H2O
2 MnO4- + MnO2(s) + 2 H2O
MnO4- a une couleur pourpre. MnO42- a une couleur verte.
Utilisations
Les principales applications du MnO2 sont les piles sèches comme les piles alcalines et les piles Zn-Cd. En 1976, cette application correspondait à une consommation d’un demi-million de tonnes annuelles de pyrolusite.
MnO2 est utilisé comme catalyseur au laboratoire pour la préparation du dioxygène à partir de chlorate de potassium ; c’est une des expériences classiques dans l’enseignement de base de la chimie. Il catalyse aussi la décomposition du peroxyde d’hydrogène :
- 2 H2O2(aq)
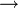 O2(g) + 2 H2O(l)
O2(g) + 2 H2O(l)
Il est aussi utilisé dans la production de permanganates comme KMnO4. Il est largement utilisé comme oxydant en chimie organique, par exemple, pour l’oxydation des alcools allyliques
Références
- ↑ a , b , c et d DIOXYDE DE MANGANESE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Dioxyde de manganèse » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du manganèse | Produit chimique nocif | Produit chimique comburant | Oxyde - Bilan: manganèse + dioxygène
Wikimedia Foundation. 2010.


