- Ammoniac
-
Ammoniac 
Molécule d'ammoniacGénéral Nom IUPAC ammoniac Synonymes azane
nitrure d'hydrogène
esprit alcalin (volatil)[1]No CAS No EINECS SMILES InChI Apparence gaz comprimé liquéfié, incolore, d'odeur âcre[2]. Propriétés chimiques Formule brute NH3 Masse molaire[5] 17,0305 ± 0,0004 g·mol-1
H 17,76 %, N 82,25 %,Moment dipolaire 1,4718 ± 0,0002 D [3] Diamètre moléculaire 0,310 nm [4] Propriétés physiques T° fusion -77,7 °C [6] T° ébullition -33,35 °C [6] Solubilité dans l'eau à 20 °C : 540 g·l-1[2] Masse volumique 0,7 g·cm-3 à -33 °C[2],
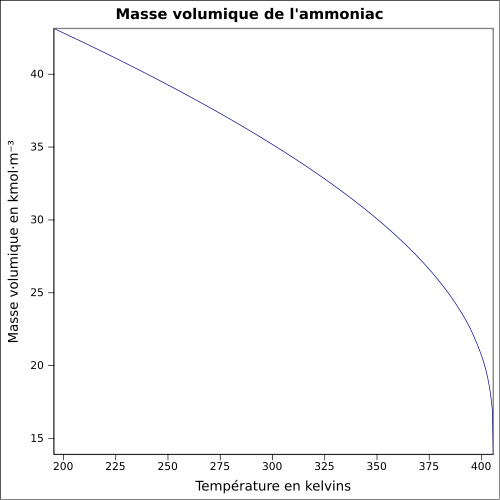
0,6813 (gaz)T° d'auto-inflammation 651 °C[2] Limites d’explosivité dans l’air Inférieure : 15,5 (Weiss, 1985)
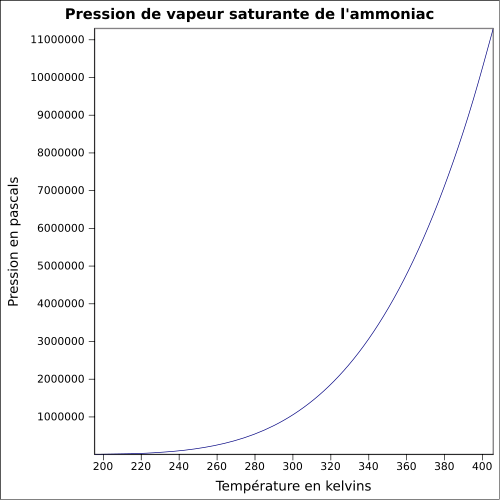
Supérieure : 27 (Weiss, 1985)Pression de vapeur saturante à 26 °C : 1 013 kPa[2] Point critique 112,8 bar, 132,35 °C [8] Thermochimie S0gaz, 1 bar 192,77 J/mol·K ΔfH0gaz -39,222 kJ·mol-1 (-273,15 °C)
-46,222 kJ·mol-1 (24,85 °C)[6]ΔfH0liquide -40,2 kJ/mol ΔvapH° 23,33 kJ·mol-1 (1 atm, -33,33 °C);
19,86 kJ·mol-1 (1 atm, 25 °C)[9]Cp 2 097,2 J·kg-1·K-1 (0 °C)
2 226,2 J·kg-1·K-1 (100 °C)
2 105,6 J·kg-1·K-1 (200 °C)[6]PCI 317,1 kJ·mol-1 [10] Propriétés électroniques 1re énergie d'ionisation 10,070 ± 0,020 eV (gaz)[11] Cristallographie symbole de Pearson  [12]
[12]Classe cristalline ou groupe d’espace P213 (n°198) [12] Strukturbericht D1[12] Structure type NH3 [12] Propriétés optiques Indice de réfraction  1,325 [4]
1,325 [4]Précautions Directive 67/548/EEC[13],[14] 
T
NPhrases R : 10, 23, 34, 50, Phrases S : 1/2, 9, 16, 26, 36/37/39, 45, 61, Transport - 1005 NFPA 704 SIMDUT[15] 


SGH[16],[14] 



DangerInhalation Les vapeurs sont très irritantes et corrosives Peau Les solutions concentrées peuvent provoquer des brûlures Yeux Dangereux, Irritation Ingestion L'ingestion peut provoquer des brûlures de la bouche, langue, œsophage Écotoxicologie Seuil de l’odorat bas : 0,04 ppm
haut : 53 ppm[17]Unités du SI & CNTP, sauf indication contraire. L’ammoniac est un composé chimique, de formule NH3 (groupe générique des nitrures d'hydrogène). C'est une molécule pyramidale à base trigonale : l'atome d'azote (N) est au sommet et les trois atomes d'hydrogène (H) occupent les trois coins (sommets) de la base triangulaire équilatérale. Plus précisément, l'atome d'azote « monte » et « descend » entre ce « sommet » de la pyramide et celui de la pyramide opposée, traversant ainsi la base triangulaire des atomes d'hydrogène. Cette « oscillation » s'effectue à une fréquence fondamentale de 24 GHz et a été mise à contribution dans les premières horloges atomiques.
Nomenclature
D'après la nomenclature IUPAC, l'ammoniac est le plus simple des azanes[18], ou hydrures d'azote acycliques.
Production industrielle
Dans les conditions « ambiantes », il se présente sous la forme d'un gaz incolore (produisant une fumée de condensation à haute concentration) et dégageant une très désagréable odeur putride.
 Réacteur chimique à haute pression et à parois d'acier utilisé pour la synthèse de l'ammoniac selon le procédé Haber-Bosch. Il a été construit en 1921 par BASF. En 2009, il est érigé à l'entrée de l'université de Karlsruhe en Allemagne
Réacteur chimique à haute pression et à parois d'acier utilisé pour la synthèse de l'ammoniac selon le procédé Haber-Bosch. Il a été construit en 1921 par BASF. En 2009, il est érigé à l'entrée de l'université de Karlsruhe en Allemagne
La production industrielle de l'ammoniac se fait essentiellement par synthèse directe à partir de dihydrogène et de diazote (procédé Haber-Bosch). Le diazote est fourni par l'air et le dihydrogène par vaporeformage du méthane (gaz naturel).
Qui peut se décomposer en :
- Production de dihydrogène par vaporeformage (voir l'article dihydrogène) :
- Synthèse de l'ammoniac :
Ancienne méthode de fabrication
Anciennement, l'ammoniac était obtenu par distillation du purin et du fumier.
Au début du XXe siècle, différents procédés de synthèse ont été imaginés.
L'un d'entre eux se base sur l'hydrolyse de la cyanamide calcique, elle-même obtenue à partir du carbure de calcium.L'autre utilise l'hydrolyse du nitrure d'aluminium, lui-même produit par nitruration à haute température de l'alumine.
Il faudra attendre 1913 pour voir apparaitre le procédé Haber-Bosch encore employé au XXIe siècle.
Propriétés physicochimiques
- Odeur : très âcre et facilement reconnaissable, nocif par inhalation (mortel à hautes doses).
- Inflammabilité et explosibilité : sous forte pression, l'ammoniac peut former un mélange explosif avec les huiles de lubrification, le mélange air-ammoniac s'enflamme et explose violemment.
- Surchauffe de compression : la valeur élevée du rapport α=Cp/Cv = 1,335 à 0 °C limite rapidement le taux de compression admissible du fait des hautes températures des vapeurs de refoulement, températures qui risqueraient au-delà d'une température de 120 °C une altération des huiles de lubrification et la formation d'un mélange détonant.
- Corrosion des métaux, joints et lubrifiants : attaque le cuivre et tous ses alliages. C'est la raison pour laquelle les installations frigorifiques fonctionnant à l'ammoniac sont réalisées avec des tuyauteries en acier.
- Miscibilité et solubilité : très soluble dans l'eau et non miscible avec les huiles naphténiques et les huiles de synthèse. Lorsqu'il est dissout dans l'eau, le gaz ammoniac forme une solution aqueuse de ce gaz, nommée l’ammoniaque, et donne lieu à un équilibre peu dissocié. L'ion ammonium NH4+ en solution comporte alors un atome d'hydrogène aux quatre sommets du tétraèdre. En absence d'espèces chimiques comportant des hydrogènes acides (l'eau et les alcools inclus), l'ammoniac peut également perdre un proton, H+, et donner l'ion amidure, NH2-, qui est une base forte.
Biochimie, Ammoniac dans l'environnement
 L'amoniac dans le cycle de l'azote
L'amoniac dans le cycle de l'azote
- L'azote est nécessaire à la synthèse des acides aminés, qui sont les éléments constitutifs des protéines. L'azote abonde dans l'air (dont il constitue environ 75% du volume), mais peu d'êtres vivants sont capables de l'utiliser directement.
Dans l'écosystème, l'ammoniac, à condition d'être dilué (dans l'eau il donne l'ion ammonium (NH4+) est une importante source d'azote assimilable pour les systèmes vivants, via les plantes. En temps normal, dans l'environnement, il est transformé en nitrites puis en nitrates dans le cycle de l'azote.
- Les plantes terrestres, pour la plupart, exploitent l'ammoniac et d'autres déchets azotés incorporé dans le sol par les matières en décomposition. Quelques unes sont parasites ou hémiparasites d'autres plantes. D'autres, comme les légumineuses fixatrices d'azote, bénéficient de relations symbiotiques avec les rhizobiums qui créent ammoniac à partir de l'azote atmosphérique[19].
- Chez l'animal, l'ammoniac joue un rôle à la fois dans la physiologie normale et anormale. Il est biosynthétisé travers le métabolisme des acides aminés normaux, mais est toxique (plus ou moins selon les espèces et la durée d'exposition) à des taux élevées[20].
Le foie transforme l'ammoniac en urée par une série de réactions faisant partie du cycle de l'urée.
Un dysfonctionnement hépatique, tels que celui observé chez l'homme avec la cirrhose, peut conduire à des quantités élevées d'ammoniac dans le sang (hyperammoniémie). De même, le fonctionnement défectueux des enzymes responsables de cycle de l'urée, tels que l'ornithine transcarbamylase conduit à une hyperammoniémie. L'Hyperammoniémie contribue à la confusion mentale et peut conduire au coma de l'encéphalopathie hépatique, ainsi qu'à des maladies neurologiques ( fréquentes chez les personnes présentant des anomalies du cycle de l'urée et des aciduries organiques[21].
L'ammoniac est important pour les animaux chez les quels il participe aux équilibres acide/base normaux ; Après la formation d'ammonium à partir de glutamine,l'α-cétoglutarate peut être décomposé en produisant deux molécules de bicarbonate qui deviennent disponibles comme « tampon » pour les acides alimentaires.
L'ammonium est excrété dans les urines, entraînant une perte nette d'acide.
L'ammoniac peut se diffuser à travers les tubules rénaux, s'y combiner avec un ion hydrogène, et permettre ainsi l'excrétion supplémentaire d'acide [22].
Médecine et ammoniac
En pathologie humaine, une augmentation de l'ammoniac sanguin est signe de mauvais fonctionnement du foie.
L'ammoniac issu de la dégradation des acides aminés dans le tube digestif est transformé en acide urique dans le foie et toute dégradation du foie entraine une augmentation du taux d'ammoniac dans le sang.Utilisations
Sous forme gazeuse, l'ammoniac est utilisé par l'industrie pour la fabrication d'engrais, d'explosifs et de polymères. L'ammoniac gazeux, qui donne 82 % d'azote, sert aussi d'engrais azoté ; il est injecté directement dans le sol sous forme d'ammoniac liquéfié sous pression.
On le trouve aussi dans la cigarette. Les fabricants l'ajoutent à la préparation du tabac en raison de sa faculté à faciliter et augmenter l'absorption de la nicotine, composé addictif du tabac.
Réfrigération
L'ammoniac est utilisé comme fluide frigorigène et est désigné par la référence R717.
- La lettre R signifie réfrigérant.
- 7 : les fluides frigorigènes d'origine inorganique sont répertoriés dans la série des 700. Le chiffre des centaines est donc un 7.
- 17 : le chiffre des dizaines et celui des unités ici représentent la masse molaire de la molécule à savoir M(NH3)=17,0 g.mol-1.
Carburant
L'ammoniac est un vecteur énergétique car il permet de transporter de l'hydrogène sous une forme dont le stockage est relativement simple. Il brûle difficilement dans l'air mais la combustion est facilitée par une décomposition partielle par passage sur un catalyseur.
En 1872, le docteur Emile Lamm, dentiste français émigré aux Etats Unis, dépose plusieurs brevets sur un moteur à l'ammoniac et met ce système en application sur une ligne des tramways de La Nouvelle-Orléans.
Pendant la Seconde Guerre mondiale, des véhicules (notamment des autocars en Belgique) ont fonctionné avec de l'ammoniac. Dans les années 1960, l'armée américaine s'y est intéressée dans le cadre du concept MED (Mobile Energy Depot) qui visait à produire directement les carburants sur le champ de bataille à partir de réacteurs nucléaires transportables[23],[24].
Au XXIe siècle, l'ammoniac fait l'objet de nouvelles études pour des moteurs classiques sans émissions de CO2 et pour le fonctionnement de piles à combustible.
Détection des fuites
Du fait de son odeur particulière, une fuite d'ammoniac est facilement identifiable à l'odorat. Techniquement, on utilise une baguette soufrée, qui enflammée au voisinage d'émanation d'ammoniac produit une fumée blanche dense permettant ainsi de localiser l'origine de la fuite. La recherche de fuite sur une installation ammoniac ne peut se faire qu'à l'aide d'un ARI (appareil respiratoire individuel) du fait de sa très forte toxicité.
Toxicologie
Au-delà d'une certaine dose, par inhalation, ou suite à une production par l'organisme lui-même (intoxication endogène par fonctionnement anormal du rein, du foie, des muscles, ou de l'intestin), l'ammoniac est toxique, induisant[25] :
- un altération des astrocytes, en modifiant les protéines astrocytaires (Glial fibrillary acidic protein)
- une altération des échanges ioniques cellulaires
- une altération des secrétions des NT
L'origine d'une hyperammoniémie peut être directe (éventuellement génétiquement acquise) :
* une acidose (le plus souvent, production de NH4 associée à un défaut d'élimination rénale)- une insuffisance hépatique sévère
- une toxicose médicamenteuse (ex : valproate)
- une prématurité, avec défaut de perfusion, liée à une immaturité hépatique (chez le bébé, dans les 24 à 72 heures suivant la naissance, se traduisant par des vomissements, une hypothermie, Hyperventilation et conduisant au coma).
L'origine peut aussi être indirecte[25], avec
- une acidurie organique
- Déficit de la B oxydation des AG
- Déficit de la chaîne respiratoire
Le taux sanguin normal d'ammoniac est 11 à 45 µmol/L. Au-delà de 50 µmol/L, on peut parler d'hyperammoniémie (quelques centaines à plus de 1 000 µmol/L) peut être déclenchée par un changement important dans l'alimentation, un stress important, une infection, et se traduit par des douleurs abdominales, une hépatomégalie, cytolyse, IHC avec troubles digestif (anorexie, un dégoût pour les mets protéinés en particulier viande et poisson), des troubles neuropsychologiques (asthénie, somnolence...), troubles de l'humeur du comportement et de la personnalité (irritabilité...), de l'élocution, hallucinations, crises ataxiques ou convulsives puis coma hyperammoniémique). Ces symptômes n'étant pas spécifiques, le diagnostic peut être difficile à poser. Chez l'adulte, il peut être suggéré par un retard mental et/ou psychomoteur, des troubles du comportement, une microcéphalie avec atrophie cérébrale, un régime végétarien avec aversion pour les protéines, un syndrome de Reye[25].
L’ammoniac étant labile, le prélèvement sanguin (au moins 1 ml de sérum en tube hépariné ou avec EDTA) doit être fait si possible lors d'une crise et rapidement transporté dans de la glace (en moins de 15 min) puis centrifugé et décanté le plus vite possible par un laboratoire prévenu d'avance de son arrivée. Il peut être conservé 2 heures à +4 °C ou 48 heures à -20 °C[25]. Le sang veineux en contient naturellement près de 2 fois plus que le sang artériel ou capillaire, et le nouveau-né en produit naturellement plus (34-102 µmol/L pour le sang veineux, et 50 à 128 µmol/L pour le sang artériel pour un nouveau-né de 3 jours) que l'enfant ou l'adulte[25].
Le diagnostic différentiel doit faire éliminer[25] ;
- d'autres formes d'encéphalite
- l'épilepsie
- une intoxication alimentaire
- une porphyrie
- la thrombose veineuse cérébrale
- une tumeur cérébrale
- etc.
Impact environnemental
Les impacts toxicologiques de l'ammoniac semblent assez bien connu, mais ses impacts écotoxicologiques, autres que liés à son caractère basique ou eutrophisant sont moins bien étudiés.
On sait que
- Les quantités d'ammoniac rejetées dans l'atmosphère en font l'un des principaux responsables de l'acidification de l'eau et des sols[26], ainsi qu'un facteur favorisant les pluies acides[27]. En France et en Europe, le secteur de l'agriculture est à l'origine de 95% des émissions d'ammoniac[28]. 80% des émissions proviennent de la volatilisation des déjections animales ; Les 20 % restant sont principalement liés à la production des engrais azotés et à leur épandage, difficile à adapter aux aléas climatiques[28].
- Il s'agit du principal responsable de l'eutrophisation des milieux aquatiques[26].
- Avec un GWP («Global Warming Potential») de 0[29], l’ammoniac est un fluide frigorigène sans effet sur le réchauffement climatique, contrairement aux fluides frigorigènes type HFC couramment utilisés dans les climatiseurs et pompes à chaleur dont le GWP peut varier de 1430 (R134A)[29] à 3900 (R404A)[29].
- De même, avec un ODP ("Potentiel de déplétion ozonique") de 0[30], l'ammoniac est un fluide frigorigène sans effet sur la couche d'ozone, contrairement aux fluides frigorigènes type HCFC dont le plus connu est le R22 encore courant dans les systèmes de climatisations anciens.
- Dans l'eau, bien que considéré comme non-toxiques aux doses où il est aujourd'hui présent, il semble discrètement affecter le métabolisme de tous téléostéens (l'infra-classe des Teleostei qui regroupe l'écrasante majorité des espèces de poissons actuels, soit environ 23 600 espèces actuellement connues), par exemple en diminuant les réflexes ce ces poissons [31][32].
- Une certaine toxicité est également constatée chez des animaux primitifs comme les amphipodes [33]
Phrases de risque et conseils de prudence selon l'INRS
Article détaillé : Signalisation des substances dangereuses.R10 – Inflammable.
R23 – Toxique par inhalation.
R34 – Provoque des brûlures.
R50 – Très toxique pour les organismes aquatiques.
S9 – Conserver le récipient dans un endroit bien ventilé.
S16 – Conserver à l’écart de toute flamme ou source d’étincelle. Ne pas fumer.
S26 – En cas de contact avec les yeux laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S36/37/39 – Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage.
S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette).
S61 – Ne pas rejeter dans l’environnement. Consulter les instructions spéciales / la fiche de données de sécurité.
Référence ONU pour le transport des matières dangereuses
- Classe 2
- numéros :
- 1005 (ammoniac anhydride)
- 3318 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 50 % d'ammoniac)
- 2073 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 35 % mais au maximum 50 % d'ammoniac)
- numéros :
- Classe 8
- numéro 2672 (ammoniac en solution aqueuse de densité comprise entre 0,880 et 0,957 à 15 °C contenant plus de 10 % mais au maximum 35 % d'ammoniac)
Voir aussi
Liens externes
Notes et références
- P.H.Nysten, Dictionnaire de médecine, de chirurgie, de pharmacie, des sciences accessoires et de l'art vétérinaire, Société typographique belge, 1840p.345
- AMMONIAC (ANHYDRE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) T.A. Czuppon et al., Kirk-Othmer encyclopedia of chemical technology 4th ed. : Ammonia, vol. 2, John Wiley & Sons.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- Magalie ROY-AUBERGER, Pierre MARION, Nicolas BOUDET, Gazéification du charbon, ed. Techniques de l'Ingénieur, Référence J5200, 10 Dec 2009, p. 4
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- The Ammonia (NH3, D1) Structure sur http://cst-www.nrl.navy.mil/. Consulté le 17 décembre 2009
- ESIS. Consulté le 6 décembre 2008
- SIGMA-ALDRICH
- « Ammoniac » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Ammonia sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Référence IUPAC
- Adjei, M.B.; Quesenberry, K.H. and Chamblis, C.G. (June 2002). "Nitrogen Fixation and Inoculation of Forage Legumes". University of Florida IFAS Extension
- "PubChem Substance Summary", consulté 2009-07-07.
- Zschocke, Johannes, and Georg Hoffman (2004). Vademecum Metabolism. Friedrichsdorf, Germany: Milupa GmbH.
- Rose, Burton, and Helmut Rennke (1994). Renal Pathophysiology. Baltimore, Maryland: Williams & Wilkins. ISBN 0-683-07354-0.
- http://www.osti.gov/energycitations/product.biblio.jsp?osti_id=4307142
- C.G. Garabedian, J.H. Johnson The theory of operation of an ammonia burning internal combustion engine US Army tank automotive center, Warren Michigan 1963
- Gaspard Beaune, Les hyperammoniémies Présentation ppt - Laboratoire de biochimie CHRA- Jeudi 26 septembre 2002, consultée 2011-10-04
- Source : Ifen
- Source : Ademe
- Source : Commission Européenne
- International Institute of refrigeration Ammonia as a Refrigerant 3ème édition, Dr A.B. Pearson, 2008
- Michèle Mondot, Ahmed Bensafi, Christophe Marvillet L'après R22 - Guide des fluides frigorigènes pour la climatisation, Publications du CETIAT, 2002
- McKenzie, D.J., Shingle, A., Claireaux, G. & Domenici, P.(2009). Sub-lethal concentrations of ammonia impair performanceof the teleost fast-escape response. Physiol.Biochem. Zool. 82, 353–362
- McKenzie, DJ, de bardeaux, A., Claireaux, G. & Domenici, P.(2009)
- Prenter, J., MacNeil, C., Dicka, J.T.A., Riddella, G.E. &Dunn, A.M. (2004). Lethal and sublethal toxicity of ammoniato native, invasive, and parasitised freshwater amphipods.Water Res. 38, 2847–2850.
- Portail de la chimie
- Portail du froid et de la climatisation
Catégories :- Produit chimique toxique
- Produit chimique dangereux pour l'environnement
- Produit chimique corrosif
- Composé de l'azote
- Composé de l'hydrogène
- Amine
- Réfrigérant
- Produit chimique domestique
- Métabolisme de l'azote
- Engrais azoté
- Chimie clinique
Wikimedia Foundation. 2010.