- Halogene
-
Halogène
Les halogènes sont une série chimique constituée des éléments chimiques du groupe 17 (aussi appelé groupe VII ou VIIA) du tableau périodique. Les éléments suivants sont des halogènes : fluor 9F, chlore 17Cl, brome 35Br, iode 53I, et astate 85At. Le mot « halogène » vient du grec hals qui veut dire sel, et gene qui porte l'idée d'engendrer.
On les trouve sous forme de molécules diatomiques dans la nature. Les halogènes possèdent 7 électrons dans leur couche électronique la plus extérieure et donc leur configuration électronique la plus stable se fait par gain d'un électron. Lorsqu'ils gagnent cet électron, ils forment un ion négatif appelé ion halogénure.
A 0 °C sous la pression atmosphérique, le fluor et le chlore sont gazeux, le brome est liquide, et l'iode et l'astate sont solides.
Leur configuration électronique quantique est de la forme ns2 np5.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Sommaire
Usages pratiques
Éclairage
En réagissant avec le tungstène qui s'oxyde et s'évapore du filament d'une lampe pour former l'halogénure gazeux correspondant, un halogène (généralement le brome ou l'iode) limite le dépôt de tungstène sur les parois de verre de quartz plus froides. Puis l'halogénure de tungstène ainsi formé se décompose sur les points les plus chauds du filament ce qui le régénère et allonge la durée de vie des lampes à halogène.
Photographie
Selon le type de film photographique, des cristaux de chlorures, bromures et/ou d'iodures d'argent absorbent la lumière de diverses couleurs. Ces cristaux exposés deviennent capables de réagir avec les révélateurs pour former les grains de l'image.
Hygiène
Le chlore, le brome, l'iode et leurs dérivées comme l'eau de Javel et la teinture d'iode, etc. servent comme désinfectants et comme blanchisseurs (pour le papier et les tissus).
Alimentaire
Le sel de table est le chlorure de sodium.
Les sels de chlore (chlorures) sont nécessaires à la vie terrestre.
Les sels d'iode (iodure) sont nécessaires à la santé humaine, (voir glande thyroïde).
Le sucralose dérive du chlore et du sucre de canne.Pharmaceutique
De très nombreux médicaments contiennent des halogènes.
exemples :
- Les agents anesthésiques volatils chloroforme, halothane, enflurane, desflurane, sévoflurane et isoflurane.
- Le bromure de potassium était utilisé comme somnifère.
Polymères
Le polychlorure de vinyle (PVC), polytétrafluoroéthylène (Teflon), polydifluoroéthylène, polychlorotrifluoroéthylène (CTFE)
Solvants
Dichlorométhane, chloroforme, trichloréthylène, etc...
Fréon, halon, etc...Propriétés physiques
Comme pour la plupart des groupes du tableau périodique, les propriétés physiques des groupe 17 (groupe des halogènes) varient progressivement du haut vers le bas du groupe : pour les halogènes, leur température de fusion et leur température d'ébullition croît en même temps que la polarisabilité de leur cortège électronique : plus cette polarisabilité est grande, plus grande est l'énergie requise pour rompre les liaisons intermoléculaires permettant les changements d'états du plus condensé au moins condensé.
Réactivité des Halogènes
Dans cette famille, les éléments réagissent avec des métaux pour former des composés ioniques tels que NaCl et LiF. Les halogènes réagissent aussi avec des non-métaux pour former des composés covalents. Des exemples de composés covalents sont les oxacides (ex : HClO3), les oxydes halogénés (ex : Cl2O) et les halogénures non-métalliques (ex : ClF). D’ailleurs, la raison pour laquelle les halogènes sont très réactifs est expliquée par le fait que les éléments du groupe 7A doivent juste gagner un électron pour remplir leur orbitale de valence p et ainsi compléter l’octet. Ceci peut être fait de deux façons :
- Gagner un électron provenant venant d’un métal, pour former un ion négatif tandis que le métal formera un ion positif
- Partager un électron avec un non-métal pour former une liaison covalente
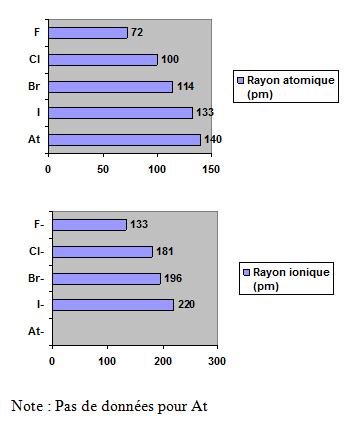
En se déplaçant de haut en bas dans le du groupe 7A, il y a une augmentation du rayon atomique et une diminution de l’électronégativité.
Les halogènes possèdent la plus grande variation d’électronégativité de tous les groupes du tableau périodique (selon l’échelle de Pauling, XF = 4,0, XAs = 2,2). Dans la plupart des réactions, ces éléments agissent comme agents d’oxydation. Aussi, les halogènes qui sont plus haut dans le groupe peuvent oxyder les anions halogénures qui sont plus bas :
F2 (g) + 2X- (aq) → 2F- (aq) + X2 (aq) où X= Cl, Br, I
Donc, la capacité d’oxydation de X2 diminue lorsqu’elle descend du groupe 7A tandis que la capacité de réduction de X– augmente lorsqu’elle descend du groupe. Plus l’ion est gros, plus il est facile de perdre un électron.
Les propriétés périodiques et les halogènes
Dans ce groupe, la configuration électronique est ns2np5. Ces éléments possèdent une orbitale p à moitié pleine capable de recevoir un électron provenant d’un autre élément, tel un alcalin. Les graphiques suivants démontrent, pour le groupe des halogènes, que l’énergie d’ionisation et l’électronégativité diminuent de haut en bas.
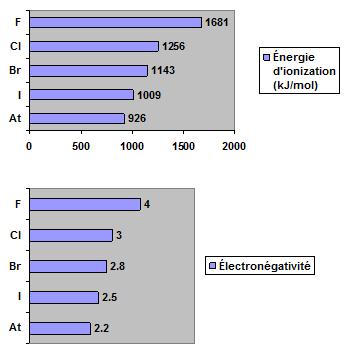
Les graphiques suivants démontrent que le rayon atomique et le rayon ionique des halogènes augmentent de haut en bas.
La chimie des composés inter-halogènes
Ces halogènes réagissent de façon exothermique pour former des composés inter-halogènes. Les molécules les plus simples dans ce domaine sont les molécules diatomiques, comme le ClF ou le BrCl. La formule générale des composés inter-halogènes est XYn (n= 3,5,7). Dans chaque cas, l’atome central est le moins électronégatif et possède un état positif d’oxydation. Voici quelques exemples :
- Sn (s) + ClF3 (l) → SnF2 (s) + ClF (g)
- P4 (s) + 5 ClF3 (l) → 4 PF3 (g) + 3 ClF (g) + Cl2 (g)
- 2B2O3 (s) + 4 BrF3 (l) → 4 BF3 (g) + 2 Br2 (l) + 3 O2 (g)
Notes et références
- Silberberg, M.S., Chemistry: The molecular nature of Matter and Change (3e édition, McGraw-Hill 2009), p. 588-594
- Petrucci R.H., Harwood W.S. et Herring F.G., General Chemistry (8e édition, Prentice-Hall 2002)
- “Chem4kids” (http://www.chem4kids.com/files/elem_halogen.html)
- “Chemistry explained” (http://www.chemistryexplained.com/Ge-Hy/Halogens.html)
- “Bodner research web” (http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch10/group7.php)
Voir aussi
Articles connexes
Liens externes
- UICPA : Page de liens vers le tableau périodique
- UICPA : Tableau périodique officiel du 22/06/2007
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégorie : Halogène
Wikimedia Foundation. 2010.
